[Forside] |
Påvisning af virus i vand og toskallede bløddyr
- Metoder og validering |
Indholdsfortegnelse
1. Forord
2. Sammendrag
2. Summary
3. Indledning
4. Bestemmelse af virus i vand
4.1 Koncentreringsmetoder
4.1.1 Filter-adsorption-elueringsmetode
4.1.2 Ultrafiltrering
4.1.3 Filtrering gennem granuleret aktivt kul
4.1.4 PEG præcipitation
4.1.5 Organisk flokkulation
4.2 Påvisningsmetoder
4.2.1 Cellekulturer
4.2.2 EIA (enzyme immunosorbent assay)
4.2.3 Polymerase chain reaktion (PCR)
4.2.4 RT-PCR-assay. Enterovirus i grundvand
4.2.5 RT-PCR-assay. Enterovirus i flodvand og havvand
4.2.6 RT-PCR-assay. Enterovirus i spildevand
4.2.7 RT-PCR-assay. Enterovirus, hepatitis E virus
og rotavirus i drikkevand
4.2.8 RT-PCR-assay. Norwalk virus i drikkevand og spildevand
4.2.9 RT-Seminested PCR assay
4.2.10 RT-Seminested PCR assay.Enterovirus i podet drikkevand
4.2.11 RT-Seminested PCR assay. Enterovirus i overfladevand
4.2.12 RT-Seminested PCR assay. Enterovirus og hepatitis A
virus i
overfladevand
4.2.13 Nested PCR asssay. Adeno-, entero- og hepatitis A virus
i
spildevand og flodvand
4.3 Validering af metoder
4.4 Diskussion
5. Bestemmelse af virus i toskallede bløddyr
5.1 Introduktion.
5.1.1 Hvordan opkoncentreres virus i toskallede bløddyr
5.1.2 Hvilke toskallede bløddyr
5.1.3 Hvilke virus opkoncentreres i toskallede bløddyr
5.1.4 Virusepidemier i Danmark ved indtagelse af toskallede
bløddyr
5.1.5 Indikator
5.1.6 Viruselimination fra toskallede bløddyr
5.2 Genrelt om metoder
5.3 Molekylærbiologiske metoder
5.4 PCR tilpåvisning af virus i toskallede bløddyr
5.5 Opsummering og diskussion
6 REFERENCER
Bilag 1 Fortegnelse over databaser for litteratursøgning
Bilag 2 Metoder til opkoncentrering af virus fra vand
Bilag 3 Opkoncentreringsmetoders fordele og ulemper
Bilag 4 Opkoncentrering af virus fra vand
Bilag 5 Metoder til påvisning af virus i vand, fordele
og ulemper
Bilag 6 RT-PCR assay til påvisning af enterovirus i vand
Bilag 7 RT-seminested PCR til påvisning af enterovirus i vand
Bilag 8 Metoder til påvisning af virus i toskallede bløddyr
Bilag 9 Beskrivlese af PCR
Bilag 10 Detektion af virus i toskallede bløddyr ved RT-PCR
Bilag 11 Detektion af virus i toskallede bløddyr ved
antigen capture RT-PCR
Bilag 12 Semi-nested TR-PCR på naturligt kontaminerede
toskallede bløddyr
Bilag 13 Oversigt over metoder til påvisning af virus i
toskallede bløddyr
1. Sammendrag
Den rutinemæssige mikrobiologiske kvalitetsvurdering af vand og toskallede bløddyr er i Danmark baseret på forekomst af coliforme bakterier. Påvisning af humane enteriske virus i vand og toskallede bløddyr udføres ikke rutinemæssigt. Den foreskrevne metode, der beror på dyrkning af infektiøse virus i cellekulturer, er meget tids- og arbejdskrævende. I forbindelse med en sundheds- og miljømæssig vurdering af virus forekomst i vand og toskallede bløddyr samt spredning i vandmiljøer er der behov for hurtige og pålidelige metoder.
Udvikling af molekylærbiologiske teknikker eksempelvis Polymerase Chain Reaction (PCR) til påvisning af virus nukleinsyre har medført, at analyseresultater kan foreligge inden for kort tid. PCR har en høj sensitivitet og specificitet og kan påvise Norwalk virus, som ikke kan vokse i cellekulturer samt vanskeligt dyrkbare virus som hepatitis A. Sensitiviteten og specificiteten af PCR kan forøges ved nested PCR, der er en to-trins PCR reaktion. Vanskeligheder med PCR skyldes hovedsagelig kemiske komponenter i prøvematerialet, der kan inhibere enzymreaktioner og dermed forringe sensitiviteten. Der er forsat behov for forskning inden for metoder der effektivt fjerner PCR inhiberende stoffer.
Virus, der generelt forekommer i meget små mængder i vand, skal opkoncentreres for at kunne påvises. Den foretrukne metode til koncentrering af virus fra vand er ifølge American Public Health Association filtermetoden, hvor virus adsorberes til og elueres fra filtermembraner. Metoden kan opkoncentrere virus fra vand med såvel lavt som højt indhold af organisk materiale. Efterfølgende rekoncentreres eluater ved organisk flokkulation eller polyethylen glycol (PEG) præcipitation.
PCR teknikken påviser virus nukleinsyre og dermed ikke nødvendigvis infektiøse virus. Enterovirus nukleinsyre er omgivet af et kapsid, der beskytter mod det ydre miljø, og påvist nukleinsyre formodes derfor at være isoleret fra intakte viruspartikler. I de tilfælde hvor det er ønskeligt at påvise infektiøse virus kan celledyrkning kombineres med PCR under betingelse af, at de pågældende virus er dyrkbare. De til dato opnåede resultater indikerer, at der er væsentlige fordele ved PCR og at metoden kan være af betydning for videre fremskridt inden for teknikker til påvisning af humane enteriske virus i vand og toskallede bløddyr.
1. Summary
The Danish routine microbiological quality assessment of water and shellfish detects the presence of coliform bacteria. Detection of human enteric viruses is not carried out as a routine procedure. The standard method of detection of infectious viruses involves cell cultures which is expensive and time-consuming. Rapid and reliable methods have to be developed for assessment of the health and environmental aspects of viruses in water and shellfish.
The development of molecular biological techniques, e.g. Polymerase Chain Reaction (PCR) for the detection of viral nucleic acid, has resulted in the fact that analysis results can be obtained within a very short time. PCR has a high sensitivity and specificity, and it can detect the Norwalk viruses which cannot grow in cell cultures as well as other viruses which are difficult to cultivate such as hepatitis A. The sensitivity and the specificity of PCR can be increased by nested PCR which is a two-step PCR reaction. The difficulties tied to PCR are mainly contributed to chemical components in the samples inhibiting the enzyme reactions and thereby reducing the sensitivity. There is still a need for developing new methods which efficiently remove PCR-inhibiting substances.
Viruses which generally are found in very small numbers in water must be concentrated in order to be detected. According to the American Public Health Association the filter method is the preferred method of concentration of virus in water: the virus is absorbed by and eluted from filter membranes. This method can concentrate viruses from water with high or low content of organic material. Subsequently the eluates are re-concentrated by organic flocculation or polyethylene glycol (PEG) precipitation.
The PCR technique detects viral nucleic acid and therefore not necessarily infectious viruses. The genome of the enteroviruses is protected by a capsid against the external environment, and detected nucleic acid is probably isolated from intact virus particles. In cases where it is desirable to detect infectious viruses the cell cultivation technique can be combined with PCR under the condition that the viruses in question are cultivable.The obtained results recently indicate that PCR has some substantial advantages, and that the method can be of importance to the future progress of techniques for the detection of human enteric viruses in water and shellfish.
3. Indledning
Problemstilling
Beskyttelse af sundhed har medført en stigende opmærksomhed på virus forekomst og spredning i miljøet. Undersøgelser til bestemmelse af humane enteriske virus i vand og toskallede bløddyr er blevet udført ved dyrkning af virus i cellekulturer. Metoderne er tids- og arbejdskrævende. For at vurdere den sundheds- og miljømæssige betydning af virus forekomst i toskallede bløddyr og vand samt spredning i miljøet er der behov for hurtige og pålidelige undersøgelsesmetoder til påvisning af virus.
Den hygiejniske kvalitet af vand og toskallede bløddyr vurderes på grundlag af bakteriologiske undersøgelser. Ifølge Rådets Direktiv om kvaliteten af drikkevand (1) må drikkevand ikke indeholde patogene organismer. Hvis det er nødvendigt at udføre supplerende mikrobiologiske undersøgelser bør disse omfatte virusundersøgelser. Der er ingen krav om virusundersøgelser i Rådets Direktiv om kvalitetskrav til skaldyrsvande (2).
Ifølge Rådets Direktiv om kvaliteten af badevand (3) skal der, hvis en undersøgelse afslører en mulig tilstedeværelse af virus eller en forringelse af vandets kvalitet, foretages undersøgelser for virusforekomst. Kravværdien er, at der ikke må forefindes enterovirus i 10 liter badevand.
Cellekulturassays er tids- og arbejdskrævende og derfor mindre velegnede til rutinemæssige undersøgelser. PCR er en hurtig og sensitiv metode til påvisning af virus nukleinsyre og en fordel er desuden, at der kan påvises virustyper, som ikke kan dyrkes i cellekulturer eksempelvis Norwalk virus eller virus, der kun vanskeligt vokser i cellekulturer.
Formål
Formålet med projektet er en litteraturgennemgang af metoder til bestemmelse af virus i vand og toskallede bløddyr samt en validering af metoderne.
Fortegnelse over databaser for litteratursøgningen fremgår af bilag 1.
4. Bestemmelse af virus i vand
4.1.1 Filter-adsorption-elueringsmetode
4.1.2 Ultrafiltrering
4.1.3 Filtrering gennem granuleret aktivt kul
4.1.4 PEG præcipitation
4.1.5 Organisk flokkulation
4.2 Påvisningsmetoder
4.2.1 Cellekulturer
4.2.2 EIA (enzyme immunosorbent assay)
4.2.3 Polymerase chain reaktion (PCR)
4.2.4 RT-PCR-assay. Enterovirus i grundvand
4.2.5 RT-PCR-assay. Enterovirus i flodvand og havvand
4.2.6 RT-PCR-assay. Enterovirus i spildevand
4.2.7 RT-PCR-assay. Enterovirus, hepatitis E virus
og rotavirus i drikkevand
4.2.8 RT-PCR-assay. Norwalk virus i drikkevand og spildevand
4.2.9 RT-Seminested PCR assay
4.2.10 RT-Seminested PCR assay.Enterovirus i podet drikkevand
4.2.11 RT-Seminested PCR assay. Enterovirus i overfladevand
4.2.12 RT-Seminested PCR assay. Enterovirus og hepatitis A virus i
overfladevand
4.2.13 Nested PCR asssay. Adeno-, entero- og hepatitis A virus i
spildevand og flodvand
4.3 Validering af metoder
4.4 Diskussion
Virus forekomst i spildevand og andre vandsystemer samt jord, slam og sediment er veldokumenteret.
Spildevand
Humane enteriske virus udskilles med fæces og afledes til spildevandsystemet. Mængden af virus og de virustyper der forekommer i spildevand afhænger af den epidemiologiske status i samfundet. Rensningsprocesser fjerner 50-90% af virus fra vandfasen (4) og partikelassocierede virus aflejres i slamfasen, hvor viruskoncentionen kan være op til 10 gange større end i urenset spildevand. Mekanisk biologisk rensning med aktiv slambehandling kan reducere enterovirus med 98% (5). Antallet af virus reduceres ved slambehandling, men virus elimineres ikke.
Recipienter
Utilstrækkelig renseprocesser eller tekniske svigt kan medføre udledning af forholdsvis store mængder virus til vandrecipienter men koncentrationen af virus er på grund af fortynding og sedimentation generelt meget lav i recipienter (5). Alexander et al. 1992 (6) rapporterer dog om fund af enterovirus i 73-88% prøver af kontamineret havvand fra 2 badestationer i England.
Drikkevand
Drikkevandskilder kan være forurenet grundvand eller overfladevand fra floder og søer. I udlandet praktiseres rensning til drikkevandskvalitet ved flokkulation af organisk materiale, der fjerner de fleste virus, og sedimentation. Den efterfølgende klorering vil inaktivere resterende virus (4).
Virustyper
De virustyper der ofte forekommer i kontamineret vand er Norwalk virus, enterovirus (poliovirus, coxsackievirus gruppe A og B og echovirus), hepatitis A virus, hepatitis E virus, astrovirus, adenovirus og rotavirus. (7, 8, 9, 10). Enteriske virus, der er kendt for at forårsage gastroenteritis er Norwalk virus, rotavirus gruppe A, astrovirus og adenovirus serotyper 40 og 41 (4).
Indikator organismer
Den hygiejniske vandkvalitet vurderes på forekomst af coliforme bakterier. Mange enteriske virus er mere resistente mod fysiske og kemiske påvirkninger i det ydre miljø end coliforme bakterier. Bakteriofager foreslås ofte som indikator for virus tilstedeværelse, men mange dokumenterede undersøgelse har vist modstridende resultater over relationer mellem coliphager og virus. Spørgsmålet om bakteriofagers anvendelighed som indikator diskuteres stadig (5).
Opkoncentrering af virus
I drikkevand og recipientvand er mængden af virus generelt meget lav og for at de kan påvises i cellekulturassays eller andre assays er det nødvendigt at opkoncentrere virus fra vandprøver i størrelsesordenen 10 - 100 liter eller derover. Koncentrering kan udføres ved filtrering hvor virus adsorberer til og elueres fra filtermembraner eller andre metoder og prøvevolumen er ofte reduceret til 1 liter. En efterfølgende rekoncentrering ved organisk flokkulation eller PEG (polyethylen glycol) precipitation medfører en yderligere reduktion af prøvekoncentratet til <=30 ml.
Påvisning af virus
Den traditionelle metode til påvisning af virus i prøvekoncentrater er cellekulturassay. En fordel ved metoden er, at der påvises infektiøse virus, men de problemer der er forbundet med metoden er, at cellekulturer er følsomme overfor toksiske komponenter i prøvematerialet, og at nogle virus er vanskelige at dyrke eller ikke kan vokse i cellekulturer. For at kunne påvise sådanne virustyper går tendensen i retning af, at anvende PCR.
Koncentreringsprocesser og metoder til påvisning af virus er nærmere beskrevet i de følgende afsnit.
4.1Koncentreringsmetoder
De koncentreringsmetoder der beskrives eller refereres til i nedenstående afsnit er skematisk illustreret i bilag 2. I skemaet er desuden anført, hvilke vandtyper og prøvemængder, der er blevet koncentreret i de pågældende metoder. Metodernes fordele og ulemper er angivet i bilag 3.
4.1.1Filter-adsorption-elueringsmetode
Procedure
Filter-adsorption-eluering er den mest anvendte og veldokumenterede metode til koncentrering af virus. Ved filtrering gennem elektronegative eller elektropositive filtre vil virus adsorbere til filtermembranen og efterfølgende frigives til en proteinholdig elueringsvæske med højt pH og eluatet kan derefter rekoncentreres eksempelvis ved organisk flokkulation (11). Processen er skitseret i bilag 4.
Kapacitet
For at opnå optimal virus adsorption til elektronegative filtre skal prøven forbehandles ved tilsætning af AlCl3 og sænkning af pH til 3,5. De elektronegative filtre har en god kapacitet for virus adsorption fra vand med højt indhold af organisk materiale, hvorimod elektropositive filtre er mindre egnede fordi de hurtigere blokeres (11). Filterkapaciteten kan forøges ved forfiltrering af prøven, der fjerner suspenderet stof, men ulempen er, at partikelbundne virus også fjernes (12). American Public Health Association 1995 (11) anbefaler, at frafiltreret suspenderet stof også undersøges for virusforekomst. Ved undersøgelser af klorbehandlet vand skal kloret neutraliseres med natriumthiosulfat forud for filtreringen.
Genfindelsesgrad
Jothikumar et al. (13) beskrev i 1995 en forsøgsrække med koncentrering af virus ved filter-adsorption-eluering. 100 liter vand podet med poliovirus type 1 blev filtreret gennem elektronegative filtre og 80% af de tilsatte virus blev genfundet i eluatet. Ju-Fang et al. 1995 (14) rapporterer om genfindelsesprocenter for elektropositive filtre på 89,9%-94,6% for poliovirus og 88,6%-95,5% for coxsackievirus B3.
Fordel - Ulempe
Metoden har den fordel, at virus kan koncentreres fra store mængder vand og genfindelsesgraden for enterovirus er god. Adsorptionskapaciteten for elektronegative filtre er mest effektiv ved tilstedeværelse af multivalente kationer som Al3+ ved lavt pH men det har den ulempe, at filtrene kan blokeres af metalkomplexer, der dannes ved lavt pH (13).
4.1.2 Ultrafiltrering
Procedure
Koncentrering ved ultrafiltrering beror på, at virus tilbageholdes i membrancylinderne på grund af molekylevægt- eller størrelsesforhold. Processen kræver tilsætning af Tween 80 (5 - 10 ml pr. 100 liter prøve) for at forhindre adsorption af virus og organisk materiale til membranen (7).
Genfindelsesgrad - Ulempe
Vandprøver i størrelsesorden 100 - 1.000 liter kan koncentreres til 1 liter, og genfindelsesgraden for enterovirus er 80% og 72% for adenovirus (15). Ulemperne er, at membranudstyret er kostbart, meget tungt og vanskeligt at transportere, og at indholdet af organisk materiale i vandprøver skal være lavt.
4.1.3 Filtrering gennem granuleret aktivt kul
Procedure
Jothikumar et al. 1995 (13) har beskrevet en filtreringsmetode med anvendelse af granuleret aktivt kul (GAC). Virus adsorberer til aktivt kul og elueres med urea-arginene fosfatbuffer pH 9,0.
Genfindelsesgrad - Fordel
Der er påvist en genfindelsesgrad på 74% for poliovirus 1, men den største fordel er, at metoden er billig og mindre tidskrævende end filter-adsorptionelueringsprocessen, idet 100 liter vand kan filtreres gennem GAC på 2 timer hvorimod det tager op til 8 timer at filtrere en tilsvarende mængde ved filter-adsorption-eluering.
4.1.4PEG præcipitation
Procedure - Genfindelsesgrad
Prøver, der er koncentrerede efter ovennævnte metoder kan rekoncentreres ved PEG (polyethylen glycol) precipitation, men metoden kan også anvendes til koncentrering af råt eller renset spildevand. Prøvematerialet tilsættes PEG 8.000 (8%), og efter centrifugering kasseres den PEG holdige supernatant, og pellet resuspenderes i fosfatbuffer (16). Metoden er hurtig og enkel med gode genfindelsesprocenter for hepatitis A virus på 61% og poliovirus på 91% (17).
4.1.5Organisk flokkulation
Procedure
Organisk flokkulation er en meget anvendt metode til rekoncentrering af eluater fra filter-adsorption-elueringsprocessen. Proteiner flokkulerer ved lavt pH, og flokkulatet med adsorberede virus bundfældes ved centrifugering og resuspenderes i 5-10 ml buffer (4).
4.2Påvisningsmetoder
Virus i koncentreret prøvemateriale kan påvises i cellekulturer, immunologiske assay som EIA (enzyme immunosorbent assay) eller PCR assay. Disse metoder er beskrevet i de følgende afsnit. Metodernes fordele og ulemper er anført i bilag 5.
4.2.1Cellekulturer
Cellekulturer
Cellekulturer er den metode, der hidtidig har været brugt til påvisning af virus i vand. Cellekulturer podes med prøvemateriale og observeres for cytopatogene forandringer (CPE). Enterovirus kan dyrkes i BGM (Buffalo Green Monkey) cellekulturer i plaque assay, og adenovirus påvises ved CPE i cellekulturer (HEp-2) under flydende medium, og virus identificeres efterfølgende i en neutralisationstest. Hepatitis A virus kan dyrkes i FRhK (Fetal Rhesus Kidney) cellekulturer og rotavirus i MA104 (Rhesus menkey Kidney) celler og identificeres i immunologiske assays. Norwalk virus kan ikke dyrkes i cellekulturer.
Koncentrationsbestemmelse
I cellekulturer under flydende medie kan antallet af infektiøse virus bestemmes efter MPN metoden og angives som TCID50 (Tissue Culture Infektive Dose), hvorimod plaques kan tælles direkte i plaque assay og angives som PFU (Plaque Forming Units).
Fordel - Ulempe
Fordelen ved cellekulturer er, at der påvises infektiøse virus. Ulemperne er, at metoden er tidskrævende, og at cellekulturer er meget følsomme over for celletoksiske stoffer, som kan forekomme i prøvematerialet. Den væsentligste ulempe er, at hepatitis A virus og nogle adenovirus er langsomt voksende, og at Norwalk virus, der ofte forårsager vandbårne infektioner, ikke er dyrkbare i cellekulturer.
4.2.2EIA (enzyme immunosorbent assay)
Procedure
I EIA påvises virusantigener og metoden er baseret på antigen-antistof reaktioner. Proceduren er, at antistof bindes til en plastoverflade, og virusantigen i prøvemateriale bindes til antistoffet. Efterfølgende bindes peroxidase-konjugeret antistof til antistof/antigen komplexet, og reaktionen synliggøres ved tilsætning af substrat, der ved enzymatisk spaltning giver en farvereaktion, der kan aflæses spectofotometrisk.
Evaluering af EIA kits og LA kits
Dahling et al. 1993 (18) har evalueret 4 EIA kits og 4 LA (latex-agglutination) kits til påvisning af rotavirus for at udvælge et kit til brug i spildevandsundersøgelser. Samtidig blev 1 EIA kit til påvisning af adenovirus type 40 og 41 evalueret. Suspensioner med kendte koncentrationer af human rotavirus (Wa), simian rotavirus (SA11) eller adenovirus (41) blev anvendt til undersøgelse af sensitiviteten af de forskellige kits.
EIA procedure - Rotavirus
I EIA assayet til rotavirus coates brønde i mikrotiterplader med monoklonalt anti-human rotavirus. Prøver overføres til brøndene og inkuberer 1 time med anti-rotavirus antistof konjugeret med peroxidase. Efter vaskeprocesser med deioniseret vand tilsættes substrat med urea-peroxid og chromogen-opløsning med tetramethylbenzidin, hvorefter der inkuberes ved stuetemperatur i 10 min. Rotavirusantigen påvises via antistof konjugeret med peroxidase, der spalter substratet og udvikler en blåfarve. Farvereaktionen aflæses visuelt eller i spectrophotometer, hvor absorbansen måles ved 450 nm i en UV max kinetisk mikroplade reader (Molecular Devices Corp. Menlo Park, CA) med softmax version 2.01.
Adenovirus
En tilsvarende EIA procedure anvendes til påvisning af adenovirus.
LA procedure - Rotavirus
I LA assayet til påvisning af rotavirus tilsættes prøven til en suspension af latex partikler coated med anti-rotavirus antistof. I alle latex kits anvendes et kanin antistof rettet mod en pool af humane rotavirus. Tilstedeværelse af virus resulterer i en visuel agglutinering af partiklerne.
Sensitivitet
Evalueringen af LA rotavirus kits viste, at den højeste sensitivitet var 103 PFU/ml for rotavirus Wa og 105 PFU/ml for SA11. Den højest påviste sensitivitet i EIA kits var 102 PFU/ml for Wa og 104 PFU/ml for SA11 og dette Rotaclone kit fra Cambridge Bio-Science blev udvalgt til de efterfølgende spildevandsanalyser. EIA Adenoclone 40/41 kit, der ligeledes var fra Cambridge BioScience, havde en sensitivitet der svarede til 102 TCID50/ml.
Detektionsgrænse
Ifølge protokollen for begge kits var prøver viruspositive, når der kunne måles en absorbans på 0,150, men en statistisk analyse af A450 værdier viste, at en absorbans >0,07714 var signifikant højere end negative kontroller. På basis af denne analyse blev detektionsgrænsen sænkes til 10 PFU/ml for Rotaclone kit og 10 TCID50/ml for Adenoclone 40/41 kit.
Spildevand - Rotavirus - Adenovirus
30 spildevandsprøver fordelt på 15 indløbsprøver og 15 udledningsprøver blev koncentreret ved filter-adsorption-eluering og rekoncentreret ved flokkulation. Prøverne blev undersøgt for rotavirus og adenovirus i EIA kits. Rotavirus blev påvist i 3 indløbsprøver, og adenovirus var ikke påviselig i prøverne.
Konklusion
Dahling et al. 1993 (18) konkluderer, at sensitiviteten af Rotavirusclone og Adenoclone 40/41 kits er på niveau med sensitiviteten af cellekulturer, og at EIA kits ikke er nær så følsomme over for kemiske stoffer i spildevand som cellekulturer. En væsentlig fordel er, at metoden er hurtig i forhold til cellekulturer hvor adeno- og rotavirus kan være vanskelige at dyrke. Til gengæld er det virusantigener, der påvises, og ikke nødvendigvis infektiøse virus.
4.2.3 Polymerase chain reaktion (PCR)
Udvikling og anvendelse af PCR er et af de nyere fremskridt inden for metoder til påvisning af humane enteriske virus i vand. PCR er en in vitro metode, der enzymatisk amplificerer et ønsket nukleinsyre segment mellem to sekvens specifikke oligonucleotid primere. Metoden kan amplificere og påvise meget små mængder virus nukleinsyre i et prøvemateriale.
PCR teknikken er nærmere beskrevet i afsnit 5: "Bestemmelse af virus i toskallede bløddyr", bilag 9 "Generel beskrivelse af PCR". Der henvises til dette afsnit.
RT-PCR
Humane enteriske virus, med undtagelse af adenovirus, er RNA-virus. For at amplificere og påvise viralt-RNA er det, forud for PCR, nødvendigt at fremstille DNA kopier (cDNA) af RNAet ved hjælp af enzymet reverse transcriptase (RT). DNAet kan derefter amplificres ved PCR. Metoden kaldes RT-PCR.
PCR inhibitorer
PCR er en meget følsom teknik, og tilstedeværelse af kemiske komponenter som humussyre og metalioner i prøvematerialet inhiberer PCR reaktionen. Humussyre bindes kraftigt til proteiner og hæmmer enzymfunktioner i PCR reaktionen, og metalioner vil interferere med enzymaktiviteten, hvilket kan medføre falsk negative resultater eller non-specifikke reaktioner. PCR kan også inhiberes af beef extract, som anvendes i filter-adsorption-eluering i forbindelse med koncentrering af prøver (7).
4.2.4RT-PCR-assay. Enterovirus i grundvand
Abbaszadegan et al. (8) publicerede i 1993 resultater fra studie omhandlende udvikling af RT-PCR assay til påvisning af enterovirus i grundvand. Procedure for koncentrering af virus og påvisning i RT-PCR er nærmere beskrevet i bilag 6. Studiet omhandlede desuden evaluering af primer specificitet og sensitivitet.
Primere
De anvendte primere svarede til den 5' ikke-kodende region i poliovirus genomet, som er et meget konserveret område i enterovirus. Downstream og upstream primerne flankerer en region på 149 bp (base par).
Specificitet
Specificiteten af primerne blev testet på udvalgte enterovirus og andre enteriske virus i RT-PCR. Efterfølgende blev PCR produkter overført fra agarose gel til hybridiseringsmembran (GeneScreen Plus) for Southern hybridisering med oligoprobe mærket med (a-32P) ATP.
Hybridiseringsprodukter blev påvist efter eksponering på røntgenfilm i 48 timer.
Resultat
Der blev påvist specificitet for poliovirus type 1, 2 og 3, coxsackievirus A1, B1-B3, B5 og B6 samt echovirus type 7, 17, 19, 21, 24, 27 og 29. Andre enterovirus som echovirus 23, bovine enterovirus 1 og porcine enterovirus blev ikke påvist. Ligeledes kunne en specificitet for andre enteriske virus som hepatitis A (HM 175), Norwalk virus, calicivirus, human rotavirus (ATTC 2018-VR), rotavirus SA-11 og adenovirus serotype 41 ikke dokumenteres.
Sensitivitet - Resultat
For at bestemme primer sensitiviteten blev grundvandskoncentrat samt destilleret vand podet med poliovirus 1 (103 PFU). Efter oprensning på Sephadex G-200 og Chelex-100 søjler blev prøverne undersøgt i RT-PCR assayet. Detektionsgrænsen for RT-PCR var 0.1 PFU.
Grundvand - Resultat
Undersøgelser til påvisning af enterovirus i 10 grundvandskoncentrater blev udført ved Southern hybridisering (uden forudgående PCR), ved dyrkning i BGM cellekulturer og RT-PCR (uden efterfølgende Southern hybridisering). Enterovirus blev påvist i 2 af de 10 koncentrater efter dyrkning i cellekulturer, og 1 af disse koncentrater blev fundet positiv efter hybridisering. Ingen af koncentraterne var positive i det anvendte RT-PCR assay. I kontrolforsøg med 10 grundvandskoncentrater podet med poliovirus type 1 (LSc), 103 PFU pr. reaktionsenhed, blev poliovirus påvist i 1 af prøverne i RT-PCR. Det blev antaget, at de negative resultater skyldtes PCR inhiberende stoffer i grundvandet.
Oprensning af grundvand - Resultat
For at underbygge denne antagelse blev de 10 grundvandskoncentrater og de 10 podede koncentrater fra kontrolforsøgene oprenset på Sephadex G-100 og Chelex-100 koloner og derefter undersøgt i RT-PCR. De 2 prøver, der var fundet positive i cellekulturer blev nu også fundet positive i RT-PCR analysen. De øvrige 8 prøver forblev negative. De 10 podede koncentrater blev alle fundet positive.
Konklusion
Det blev konkluderet, at inhiberende substanser som humussyre og beef extract i grundvandskoncentraterne interfererer med PCR amplifikationen. Efterfølgende studier viste, at reverse transkriptase er mere følsom over for inhibition end Taq polymerase. Desuden konkluderede Abbaszadegan et al. 1993 (8), at det udviklede RT-PCR assay kan anvendes til påvisning af enterovirus i grundvand når inhiberende substanser er fjernet ved oprensning forud for RT-PCR.
4.2.5 RT-PCR-assay. Enterovirus i flodvand og havvand
Wyn-Jones et al. 1995 (19) har undersøgt flod- og havvand for enterovirus ved dyrkning i cellekulturer og ved RT-PCR. Undersøgelsen omfattede 15 prøver fra River Thames og 3 havvandsprøver fra rekreative områder i nordøst England.
Procedure
Prøverne blev koncentreret ved filter-adsorption-eluering med efterfølgende flokkulation. Oprensning for RT-PCR inhiberende stoffer foregik samtidig med RNA ekstraktionen, hvor RNA adsorberes til størrelsesfraktioneret Silica under tilstedeværelse af guanidinium thiocyanat. Silicaprecipitatet indvindes ved centrifugering og supernatanten, der indeholder de inhiberende substanser, kasseres.
Primere
Til RT-PCR på enterovirus blev der anvendt to primere P1 og P3 fra den 5' ikke-kodende region i enterovirus. RT-PCR produkterne blev efterfølgende bekræftet ved hybridisering med digoxigenin mærket P2 primer. Hybridiseringsprodukterne blev påvist med anti-digoxigenin antistof efter eksponering med X-ray film i 2 timer, hvorefter filmen blev fremkaldt (Boehringer Mannheim protokol). Primer lokalisering er illustreret i figur 1.
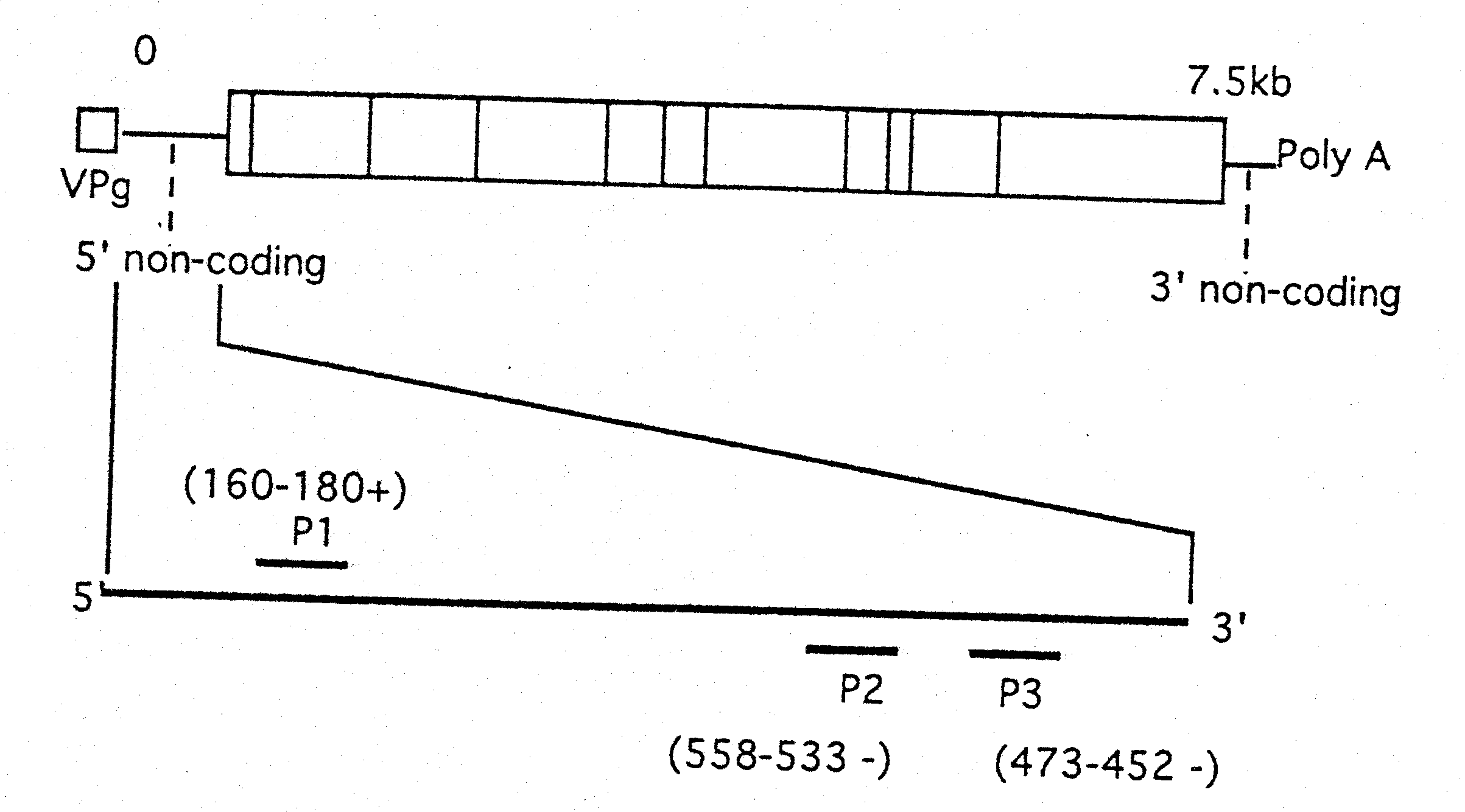
Wyn-Jones et al., 1995 (19)
Figur 1. Primer lokalisering i den 5' ikke-kodende region i enterovirus
Cellekultur
De koncentrerede prøver blev podet på BGM cellekulturer under flydende medium og observeret for virus induceret cytopatogen effekt (CPE) i 14 dage. Virus blev isoleret fra kulturer med CPE reaktion og efterfølgende identificeret i neutralisationstest. Desuden blev prøverne undersøgt for enterovirus i RT-PCR med efterfølgende hybridisering.
Resultat
I begge analysemetoder blev der påvist enterovirus i 2 havvandsprøver og 4 flodvandsprøver, men virus var ikke påviselig i 1 havvandsprøve og 4 flodvandsprøver. Undersøgelsen af disse 11 prøver viste, at der var en god korrelation mellem de to metoder.
I 3 flodvandsprøver blev der kun påvist virus i RT-PCR men derimod var 4 flodvandsprøver positive i cellekulturer, men negative i RT-PCR og årsagen hertil formodes at være inhiberende stoffer i flodvandet til trods for, at prøverne var oprenset i RNA ekstraktionen.
Konklusion
Wyn-Jones et al. (1995) foreslår, at koncentrater der er negative i RT-PCR podes på cellekulturer og inkuberer 1 døgn for at fjerne inhibitorerne. De finder, at der er god korrelation mellem de to analysemetoder, og at RT-PCR kan påvise enterovirus i de fleste prøver uden forudgående dyrkning i cellekulturer. Kombinationen af RT-PCR og hybridiseringsteknik forøger sensitiviteten.
4.2.6 RT-PCR-assay. Enterovirus i spildevand
Shieh et al. beskrev i 1995 (16) en metode til ekstraktion af RNA fra spildevand og andet fækalt affald under anvendelse af guanidinium isothiocyanate (GIT).
Procedure
Prøverne blev koncentreret ved PEG præcipitation og efterfølgende behandlet med kloroform eller Freon dels for at oprense virus og dels for at bryde virus aggregater.
Primere
Efter oprensning på Sephadex G-200 og GIT ekstraktionaktion blev enterovirus påvist i RT-PCR med primere fra den meget konserverede 5' ikke-kodende region. Det amplificerede PCR produkt på 196 bp blev efterfølgende påvist ved hybridisering med oligoprobe mærket med digoxigenin-dUTP (Boehringer Mannheim).
Sensitivitet
Der blev udført sensitivitetstests med enterovirus, der var isoleret fra cellekulturer, og detektionsgrænsen for GIT ekstraktion RT-PCR metoden blev fundet til 0,003 - 0,6 TCID50/10 ml for coxsackievirus A17 og A20 samt echovirus 16.
Spildevand
3 prøver råt spildevand og 8 prøver af andet fækalt affald blev undersøgt ved direkte RT-PCR uden forudgående RNA ekstraktion, og enterovirus blev påvist i 3 affaldsprøver. Efter GIT ekstraktion af RNA blev enterovirus påvist i 6 affaldsprøver og i 1 spildevandsprøve, og GIT ekstraktion RT-PCR metoden medførte, at antallet af positive prøver steg fra 3 til 7.
Konklusion
Den forbedrede sensitivitet tilskrives GIT metoden, der ekstraherer og separerer RNA fra viruskapsid og andet materiale i prøven samtidig med at RNA beskyttes mod degradering. Fordelen er desuden, at RNA kan ekstraheres fra 200 ml prøvekoncentrat, og mængden af templates pr. RT reaktion forøges 20 gange i forhold til den direkte RT-PCR , hvor kun 10 ml prøve undersøges.
4.2.7 RT-PCR-assay. Enterovirus, hepatitis E virus og rotavirus i drikkevand
Procedure
Jothikumar et al. 1995 (13) har udført studier med det formål, at udvikle en hurtig og enkel procedure til opkoncentrering og påvisning af virus i drikkevand.
Prøverne blev koncentrerede ved filtrering gennem granuleret aktivt kul (GAC), og eluatet blev efterfølgende rekoncentreret ved magnesiumklorid precipitation. Prøvekoncentraterne blev blandet med 1% SDS-20 mM EDTA-1M NaCl og 10% CTABNaCl, der minimerer RNase aktivitet, og virus-RNA blev derpå ekstraheret med fenol-kloroform-isoamyl alkohol.
Primere
Til RT-PCR på enterovirus blev der anvendt 2 primere svarende til det konserverede 5' ikke-kodende område i poliovirus-1, og til RT-PCR på hepatitis E virus (HEV) blev anvendt 2 primere fra det konserverede område af polymerasegenet. Til påvisning af rotavirus blev der benyttet 2 primere svarende til den konserverede region på gensegment 9, der koder for VP7 protein i rotavirus gruppe A. PCR produkter blev bekræftet ved Southern hybridisering med digoxigenin mærkede prober.
Sensitivitet
Til bestemmelse af RT-PCR metodens sensitivitet blev vandprøver podet med kendte koncentrationer af poliovirus 1, og detektionsgrænsen blev fundet til 15 PFU/100 liter.
Drikkevand
24 drikkevandsprøver, udtaget fra forskellige vandpumper i omegnen af New Dehli, blev undersøgt for enterovirus, HEV og rotavirus. Enterovirus blev påvist i 3 prøver, og rotavirus blev påvist i 8 prøver. HEV og rotavirus blev påvist i 1 prøve. Desuden blev enterovirus, HEV og rotavirus påvist i 1 prøve.
Konklusion
Forfatterne konkluderer, at den udviklede procedure, der kan påvise 15 PFU/100 liter vand, er hurtig og enkel, og at GAC metoden kan koncentrere 100 liter vand på 2 timer, og at RT-PCR resultater kan foreligge inden for samme dag.
4.2.8RT-PCR-assay. Norwalk virus i drikkevand og spildevand
Woolfaardt et al. 1995 (20) har udført undersøgelser af RT-PCR for at vurdere metodens anvendelighed til påvisning af Norwalk virus i miljøprøver.
Procedure
Undersøgelsen omfattede drikkevand, spildevand og slam podet med kendte fortyndinger af Norwalk virus samt naturligt (ikke podet) spildevand og slam. Desuden blev 10 liter overfladevand podet med Norwalk virus opkoncentreret ved glass wool-adsorption-elueringsproces. Adsorberede virus blev elueret med 3x50 ml glycine beef extrakt buffer pH 9,5. De tre eluater samt drikke-, spildevands- og slamprøver, af hver 10 ml, blev koncentreret ved centrifugering, og RNA blev ekstraheret ved PEG precipitation under anvendelse af CTAB (cetyltrimethylammonium bromide). Til RT-PCR blev anvendt et primer par 51-3, fra det konserverede område af polymerase regionen.
Resultat - Miljøprøver
Norwalk virus blev påvist i alle podede prøver, men RT-PCR sensitiviteten var højere i drikkevand end i spildevand og slam. Årsagen til den lavere sensitivitet formodes at være et højere indhold af kemiske komponenter i slam- og spildevandsprøver, der interfererer med RT-PCR reaktionen. Der blev ikke påvist Norwalk virus i de "naturlige" slam- og spildevandsprøver, men da de er en hyppig årsag til mave-tarm infektioner, var det forventet, at Norwalk virus kunne påvises i disse prøver.
Resultat - Opkoncentrering
Efter opkoncentrering blev Norwalk virus påvist i de to første eluater, hvilket indikerer, at adsorberede virus ikke umiddelbart frigives i elueringsprocessen. Desuden tydede resultaterne på, at nogle virus passerer gennem filtermatrixen, og at adsorption af virus til glass wool ikke er komplet. Vurdering af virus genfindelsesgraden er meget vanskelig, da der ikke er nogen praktiske metoder til påvisning af små mængder Norwalk virus.
Konklusion
Det blev konkluderet, at der er behov for fremtidige undersøgelser af RT-PCR sensitiviteten og metoder, der effektivt kan fjerne RT-PCR inhibitorer samt undersøgelser til vurdering og beregning af Norwalk virus genfindelsesgraden efter opkoncentrering ved glass wool-adsorption-elueringsmetoden.
4.2.9 RT-Seminested PCR assay
Seminested - Nested
Forøget sensitivitet og specificitet af RT-PCR er mulig ved anvendelse af nested PCR teknik, hvor der udføres to PCR reaktioner med forskellige primer sæt. I den første PCR reaktion anvendes et primer sæt til amplifikation af det ønskede nukleinsyre segment, mens den sekundære reaktion udføres på PCR produktet fra den første reaktion. I den sekundære reaktion kan der enten benyttes en primer fra første reaktion og en ny internal primer, og metoden kaldes seminested PCR, eller der kan benyttes to nye interne primere, og denne metode betegnes nested PCR. Metoden har desuden den fordel, at inhiberende substanser fortyndes i den sekundære PCR (7, 9).
4.2.10 RT-Seminested PCR assay. Enterovirus i podet drikkevand
I 1995 publicerede Ju-Fang et al. (14) en artikel omhandlende undersøgelser af metoder til oprensning og ekstraktion af virus-RNA for at evaluere sensitiviteten af RT-seminested PCR til påvisning af enterovirus i drikkevand. Procedurer for koncentrering af drikkevand, RNA ekstraktion og RT-seminested PCR er nærmere beskrevet i bilag 7.
Primere
Til RT-seminested PCR på poliovirus 1 og coxsackievirus B3 blev der til den første RT-PCR reaktion benyttet downstream og upstream primere, der flankerer en 149 bp region i det konserverede 5' ikke-kodende område i enterovirus. Til den sekundære RT-PCR anvendtes upstream og internal primere, der flankerer et område på 105 bp.
Sensitivitet - Resultat
Indledende undersøgelser til evaluering af sensitiviteten af RT-seminested PCR blev udført med HPLC renset vand podet med kendte koncentrationer af poliovirus 1 (LSc-2ab). De podede prøver blev varmebehandlet ved 99°C i 5 min. for at frigøre virus-RNA, eller RNA blev ekstraheret med phenol-chloroform-isoamyl alkohol (PCI). Sensitiviteten blev fundet til 0,02 PFU/10 ml efter varmebehandling og 0,2 PFU/10 ml efter ekstraktion. Efterfølgende forsøg med podet drikkevandskoncentrat viste en tilsvarende sensitivitet 0,2 PFU/10 ml efter PCI ekstraktion.
Oprensning - Sensitivitet
Undersøgelser af oprensningsmetoder, hvor drikkevandskoncentrater podet med kendte koncentrationer af poliovirus 1 og coxsackievirus B3 blev oprenset på Sephadex G-100 eller Sephadex G-50 koloner i kombination med Chelex-100, viste, at sensitiviteten var 20 PFU/10 ml efter oprensning på Sephadex G-100 og Chelex-100 og 200 PFU/10 ml efter Sephadex G-50 og Chelex-100.
Konklusion
Ju-Fang et al. 1995 (14) mener, at varmebehandling til frigivelse af RNA er den foretrukne metode, når vandprøver er oprenset og fri for inhibitorer, og at varmebehandling er enkel og hurtig sammenlignet med PCI ekstraktion. Den væsentligste ulempe er, at en oprensning er nødvendig, da PCR inhiberende substanser ikke fjernes ved varmebehandling. Oprensning på Sephadex G-50 og Chelex-100 fjerner ikke inhibitorer effektivt, derimod fjernes inhibitorer på Sephadex G-100 og Chelex-100, men til gengæld fjernes også op til 99% af virus. Studierne viste, at PCI ekstraktionsmetoden i tilstrækkelig grad kan fjerne inhiberende substanser, så der opnås en sensitivitet for RT-seminested PCR på 0,2 PFU/10 ml, der svarer til 0,2 PFU/liter drikkevand.
4.2.11RT-Seminested PCR assay. Enterovirus i overfladevand
Procedure
Kopecka et al. 1993 (21) anvendte RT-seminested PCR til påvisning af enterovirus i vandprøver udtaget fra River Seine og fra en sø i Berlin. Prøverne blev koncentreret ved filter-adsorption-eluering eller organisk flokkulation, og RNA blev ekstraheret med kloroform.
Primere
Sensitiviteten af RT-seminested PCR med efterfølgende hybridisering til påvisning af poliovirus 3, coxsackievirus B5 og echovirus 7 blev undersøgt i forhold til cellekulturassay og direkte hybridisering. De benyttede primere var P3, P2 og P5 fra det konserverede 5' ikke-kodende område i poliovirus 1, og til hybridisering anvendtes en 32P mærket riboprobe. I cellekulturassayet blev virus dyrket i Vero celler under flydende medie i 6 dage og efterfølgende påvist ved hybridisering.
Forfatterne pointerer, at kvantitative resultater ikke kan forventes under de anvendte forsøgsbetingelser, da forsøgene er baseret på optimering af sensitiviteten og ikke på kvantitative resultater.
Sensitivitet
Mineralvand podet med kendte koncentrationer af de respektive virustyper blev podet på Vero cellekulturer samt testet ved hybridisering og ved RT-seminested PCR. Man fandt, at RT-seminested PCR var 10-1.000 gange mere sensitiv end detektionen i cellekulturer og 105 -107gange mere sensitiv end den direkte hybridisering.
I andre sensitivitetsstudier er poliovirus-RNA blevet ekstraheret fra podede HeLa celler, og poliovirus cRNA blev syntetiseret in vitro fra plasmid PhK8, som indeholder cDNA af det komplette poliovirus 1 genom. RNA og cRNA blev efterfølgende påvist i koncentrationer ned til 1 nanogram/spot efter hybridisering, og 1 femtogram RNA kunne påvises i RT-seminested PCR, hvilket svarer til 200 genom kopier.
Overfladevand
RT-seminested PCR til bestemmelse af enterovirus i flod- og søvand blev først udført på "naturlige" ikke koncentrerede prøver. Disse prøver blev efterfølgende opkoncentrerede og undersøgt i RT-seminested PCR. Med undtagelse af en prøve blev enterovirus påvist i alle "naturlige" prøver, men to af de positive prøver var negative efter opkoncentrering, hvilket indikerer, at proceduren ikke kun koncentrerer virus men også PCR inhiberende stoffer, og at en oprensningsprocedure er nødvendig forud for RNA ekstraktion og RT-seminested PCR.
Enterovirus kunne ikke påvises i prøvekoncentrater efter podning på cellekulturer. Forfatterne mener, at desinfektion af renset spildevand inden udledning til recipientvandet inaktiverer størstedelen af virus, så de ikke er påviselige i cellekulturer men at de forsat er i stand til at producere positive RT-seminested PCR resultater.
Konklusion
Det konkluderes, at RT-seminested PCR kan blive en fordelagtig metode til undersøgelse af miljøprøver, men at der er behov for udvikling af oprensningsprocedurer til fjernelse af urenheder, som inhiberer PCR reaktioner.
4.2.12 RT-Seminested PCR assay. Enterovirus og hepatitis A virus i overfladevand
RT-seminested PCR har været anvendt af Guyader et al. 1995 (22) til påvisning af enterovirus og hepatitis A virus (HAV) i vandprøver fra flodmundinger i Fort de France Bay og fra flodmundinger i den sydlige del af Martinique, de Caribiske øer.
Procedure - Primere
Prøverne på 50 ml blev efter koncentrering ved PEG precipitation og RNA ekstraktion med fenol og kloroform analyseret i RT-PCR assayet. Til påvisning af enterovirus anvendtes primerne E1 og E2 samt E1 og E3 til seminested PCR fra det konserverede 5' ikke-kodende område i enterovirus. Til RT-seminested PCR på HAV benyttes primerne H1 og H2 samt H1 og H3 fra VP1 regionen.
Overfladevand
Prøvekoncentrater såvel som "naturlige" prøver indgik i undersøgelsen. I de "naturlige" prøver blev der påvist enterovirus i 2 prøver, HAV i 4 prøver og 5 prøver blev fundet positive for begge virustyper. 9 prøver var negative. To af de HAV positive prøver var svagt positive med hensyn til PCR produktets intensitet under UV. Med undtagelse af disse to svagt positive prøver, hvor HAV ikke blev påvist i de koncentrerede prøver, formodentlig pga. PCR inhibitorer, svarede antallet og fordelingen af virus positive prøvekoncentrater til de "naturlige" prøver.
Konklusion
Forfatterne konkluderer, at RT-seminested PCR tegner til at kunne blive et vigtigt redskab til påvisning af viruskontamineret overfladevand og i risikovurdering af sundhedsmæssige aspekter i forbindelse badevand.
4.2.13 Nested PCR asssay. Adeno-, entero- og hepatitis A virus i spildevand og flodvand
Puig et al. 1994 (9) har anvendt nested PCR til påvisning af adenovirus og nested RT-PCR til påvisning af enterovirus i spildevand og flodvand. Girones et al. (23) rapporterede i 1995, at undersøgelsen også omfattede nested RT-PCR til påvisning af HAV.
Procedure
Spildevandsprøver blev koncentreret ved centrifugering, og virus blev elueret fra faste partikler med glycine buffer 0,25 N pH 9,0 og efterfølgende ultracentrifugeret. Flodvandsprøver blev koncentreret ved adsorption til og eluering fra glass powder og efterfølgende koncentreret som beskrevet for spildevand. DNA og RNA blev ekstraheret fra prøvekoncentrater ved adsorption til Silica under anvendelse af guanidium thiocyanate. PCR proceduren omfattede RT-reaktion til syntese af cDNA fra enterovirus- og HAV-RNA efterfulgt af enzymatisk amplifikation af cDNA og ekstraheret DNA.
Primere
Til PCR på adenovirus anvendtes primerene hexAA1885 og hexAA1913 fra hexon genet i Ad2, Ad40 og Ad41, og til nested PCR benyttedes nehexAA1893 og nehexAA1905. Disse primere har specificitet over for 47 humane adenovirus serotyper Ad1 - Ad47. De benyttede primere til påvisning af enterovirus var Ent1 og Ent2 samt neEnt1 og neEnt2 fra det konserveret 5' ikke-kodende område i enterovirus, der har specificitet for 24 enterovirustyper. Der blev anvendte primere fra den 5' ikke-kodende region i HAV genomet, og primerne HAV1 og HAV2 blev benyttet til 1. RT-PCR reaktion og neHAV1 og neHAV2 blev benyttet til nested RT-PCR.
Miljøprøver
10 af de 16 spildevandsprøver blev undersøgt for forekomst af HAV, og alle 10 prøver var positive, men derimod kunne HAV ikke påvises i de 9 flodvandsprøver.
Enterovirus blev i nested RT-PCR påvist i 12 af de 16 spildevandsprøver, men kun 8 prøver var positive efter 1. RT-PCR og i cellekulturassayet var 5 prøver positive. Adenovirus var påviselig i alle 16 prøver efter nested PCR, hvor 7 af prøverne var positive efter 1. PCR.
I flodvand blev adenovirus påvist i 6 af de 9 prøver efter 1. PCR. Enterovirus var ikke påviselig efter 1. RT-PCR. Efter nested PCR henholdsvis nested RT-PCR blev adenovirus og enterovirus påvist i alle 9 prøver. Efter celledyrkning blev 1 prøve fundet positiv for enterovirus.
Konklusion
Undersøgelsen viste, at nested PCR og nested RT-PCR medførte en stigning i antallet af positive prøver i forhold til 1. PCR/RT-PCR reaktion, og at stigningen var særlig markant for enterovirus. Adenovirus blev påvist i alle prøverne, og på grund af denne store udbredelse foreslår Puig et al. 1994 (9), at der rettes en større opmærksomhed på adenovirus som indikator for virusforurening.
4.3 Validering af metoder
Filter-adsorption-eluering
Virus kan forekomme i meget lav koncentration i vand og skal opkoncentreres for at blive påvist i cellekulturer eller andre analysemetoder. Filter-adsorption-eluering er den foretrukne metode til koncentrering af virus fra vand. De to typer af filtermembraner, elektronegative og elektropositive, kan koncentrere virus fra store mængder vand, og genfindelsesgraden for enterovirus er høj. En ulempe ved elektronegative filtre er, at der tilsættes multivalente kationer som Al3+ ved lavt pH for at forbedre adsorptionskapaciteten, og det kan medføre dannelse af metalkomplexer der kan blokere filterne.
Ultrafiltrering
Ultrafiltreringsprocessen kan koncentrere meget store mængder vand, 100-1.000 liter, med lavt indhold af organisk stof, og den påviste genfindelsesgrad for enterovirus er på niveau med genfindelsesgraden i filter-adsorption-elueringsprocessen. I forhold til adsorption-elueringsmetoder har ultrafiltrering den fordel, at der ikke indgår en elueringsproces, da virus koncentreres på grund af molekylevægt eller størrelsesforhold. Den væsentligste ulempe ved ultrafiltrering er, at udstyret er kostbart, tungt og vanskeligt at håndtere.
Granuleret aktivt kul
Koncentrering på granuleret aktivt kul er i forhold til de to andre processer en billig og hurtig filtreringsmetode, der kan koncentrere 100 liter vand indenfor et par timer hvorimod tidsforbruget er op til 8 timer for behandling af en tilsvarende mængde i de andre metoder. En væsentlig fordel er, at koncentrering og PCR kan udføres indenfor en dag og at der derfor hurtigt kan foreligge analyseresultater, hvilket er ønskeligt med hensyn til rutineundersøgelser. Til gengæld er genfindelsesgraden for virus lavere end ved filter-adsorption-eluering og ultrafiltrering.
PEG - Organisk flokkulation
Råt spildevand kan koncentreres ved PEG (polyethylen glycol) precipitation, men metoden anvendes sædvanligvis til rekoncentrering af prøvekoncentrater fra ovennævnte koncentreringsprocesser, og genfindelsesgraden er høj. Organisk flokkulation er den foretrukne metode til rekoncentrering af eluater fra elektronegative eller elektropositive filtre.
En general ulempe ved koncentreringsmetoderne er, at der også koncentreres substanser, der kan være toksiske for cellekulturer eller inhibere PCR reaktion.
Cellekulturer - EIA
Virus i prøvekoncentrater kan efterfølgende påvises i cellekulturer, EIA eller PCR assays. I cellekulturer påvises infektiøse virus, men metoden er tidskrævende, og cellekulturer er meget følsomme over for toksiske komponenter i prøvematerialet og dertil kommer, at nogle virustyper enten ikke kan påvises eller er vanskelige at dyrke i cellekulturer. EIA er en hurtig metode til påvisning af eksempelvis adenovirus, der er langsomt voksende i cellekulturer, og metoden er mindre følsom over for kemiske komponenter i prøvematerialet end cellekulturer. Til gengæld kan sensitiviteten variere meget afhængig af det anvendte EIA kit, og da EIA påviser virus antigener kan der ikke skelnes mellem infektiøse eller inaktive virus.
PCR
PCR har en høj sensitivitet og specificitet, og resultater kan foreligge inden for timer i stedet for dage/uger, som ofte er nødvendige ved dyrkningsteknikker. PCR kan påvise ikke dyrkbare virus som Norwalk virus og vanskeligt dyrkbare virus som hepatitis A og adenovirus (20, 9). Sensitiviteten af PCR kan forøges ved efterfølgende hybridiseringsteknik. RT-seminested og nested PCR medfører en forøget sensitivitet i forhold til 1 trins PCR (9). I forhold til cellekulturassays kan sensitiviteten af RT-seminested PCR være op til 1.000 gange højere (22).
En væsentlig ulempe er, at inhiberende substanser fra prøvematerialet intefererer med PCR amplifikationen, og at PCR derfor kun i begrænset omfang kan anvendes direkte uden forudgående oprensning af prøvemateriale. Variation i sensitiviteten afhænger primært af vandkvaliteten og påvirkes derfor af koncentrerings-, oprensnings- og ekstraktionsmetodernes effektivitet samt metodernes genfindelsesgrad (10). For at optimere PCR teknikkerne er der forsat behov for forskning inden for metoder til effektiv fjernelse af inhibitorer, der influerer på PCR amplifikation.
PCR påviser virus nukleinsyre. For påvisning af dyrkbare virus kan celledyrkning kombineres med PCR.
4.4 Diskussion
Opkoncentrering af virus
Koncentrationen af virus i drikkevand og recipientvand herunder badevand kan være meget lav, og de anvendte metoder skal derfor kunne koncentrere virus fra vandmængder på 10 - 100 liter eller derover. Volumen af prøvekoncentrat, der ofte er i størrelsesorden 1 liter, reduceres yderligere til <=30 ml i den efterfølgende rekoncentreringsproces. De eksisterende koncentreringsprocesser har alle den ulempe, at også celletoksiske eller PCR inhiberende komponenter opkoncentreres.
Cellekulturer - PCR
Cellekulturassays er kostbare og tidskrævende, og de virustyper, der kan påvises, er begrænset til dem, der kan vokse i cellekulturer. Norwalk virus, der hyppigt forårsager udbrud af vandbårne infektioner, kan ikke dyrkes i cellekulturer, og andre virustyper kan være langsomt voksende eksempelvis adenovirus og hepatitis A virus. Disse virustyper kan påvises i PCR. Sensitiviteten og specificiteten af PCR kan forøges ved efterfølgende hybridisering eller ved nested PCR. Puig et al. 1994 (9) viste, at nested PCR medførte en markant stigning i antallet af positive enterovirus prøver, og at alle undersøgte prøver (16 stk.) var positive med hensyn til adenovirus. På baggrund af denne hyppige forekomst af adenovirus i miljøprøver antager forfatterne, at adenovirus tilstedeværelse i forurenet vand sandsynligvis er underestimeret, idet mange adenovirus er langsomt voksende eller vanskeligt dyrkbare i cellekulturer . Desuden mener forfatterne at der bør fokuseres mere på adenovirus som en mulig indikator for virusforurening (9).
Vanskeligheder forbundet med PCR teknikken kan være forårsaget af substanser i prøvematerialet, der inhiberer enzymfunktioner i PCR reaktionen. Der er udført mange studier med henblik på udvikling af metoder til fjernelse af inhiberende substanser. Nogle metoder fjerner effektivt PCR inhibitorer, men til gengæld kan der være risiko for, at også virus fjernes fra prøvematerialet (14). Der er derfor forsat behov for udvikling af metoder til oprensning og ekstraktion af virusnukleinsyre.
PCR påviser virus nukleinsyre. Med hensyn til enterovirus er nukleinsyren omgivet af et kapsid, der beskytter mod vandmiljøet, og påvist nukleinsyre formodes derfor at være isoleret fra intakte viruspartikler. Hvis påvisning af infektiøse virus er ønskelig, kan celledyrkning kombineres med efterfølgende PCR i de tilfælde, hvor virus kan vokse i cellekulturer (4). En anden mulighed er, at PCR kan anvendes til screening af miljøprøver inden cellekulturassays tages i brug (22).
Der er væsentlige fordele ved PCR, og metoden kan være af betydning for videreudvikling af metoder til påvisning af humane enteriske virus i vandmiljøer.
5. Påvisning af virus i toskallede bløddyr
5.1 Introduktion
5.1.1 Hvordan opkoncentreres virus i toskallede bløddyr
5.1.2 Hvilke toskallede bløddyr
5.1.3 Hvilke virus opkoncentreres i toskallede bløddyr
5.1.4 Virusepidemier i Danmark ved indtagelse af toskallede
bløddyr
5.1.5 Indikator
5.1.6 Viruselimination fra toskallede bløddyr
5.2 Generelt om metoder
5.3 Molekylærbiologiske metoder
5.4 PCR til påvisning af virus i toskallede bløddyr
5.5 Opsummering og diskussion
Det fremår af litteraturgennemgangen, at der ud fra molekylærbiologiske strategier med anvendelse af RT-PCR (revers transkription polymerase chain reaction) er udviklet de første følsomme teknikker til påvisning af virus i toskallede bløddyr. Der er behov for at videreudvikle sådanne teknikker til monitorering af virus i toskallede bløddyr, vand og sediment. Videre studier er nødvendige for specielt at belyse anvendeligheden af molekylærbiologiske teknikker til påvisning af virus af human oprindelse i toskallede bløddyr.
5.1 Introduktion
5.1.1Hvordan opkoncentreres virus i toskallede bløddyr
Toskallede bløddyrs rolle i transmission af humane virale sygdomme har været kendt længe (24).
Filterernærende mekanisme
Virus opkoncentreres i toskallede bløddyr, såsom østers og muslinger, idet disse toskallede bløddyr har en "filterernærende" mekanisme, der består i at si fødepartikler, der er suspenderet i det omgivende vand. Denne filtermekanisme sker via gællerne, idet gællerne er "site" for optagelse af ilt og næring. Gællerne har en overordentlig stor overflade, der er tæt besat med cilier, som driver vandet gennem gællerne videre til munden. Faste partikler, herunder virus, fastholdes af et slimlag og føres af ciliestrømmen hen over gællernes overflade til munden. På den måde virker gællerne som et sigteapparat, hvorved virus opkoncentreres i de toskallede bløddyrs fordøjelseskanal (25).
Filterhastighed
Filtreringshastigheden varierer en del afhængig af temperaturforhold og de toskallede bløddyrs fysiologiske aktivitet. Fysiologisk aktive toskallede bløddyr kan filtrere op til 38 l (10 gallon) vand i timen over en kortere periode, og det antages, at toskallede bløddyr kan opkoncentrere virus fra det omgivende vand mindst 100 fold (26). Da toskallede bløddyr ofte spises rå eller lettere kogt, er der dermed risiko for smitte med humane enteriske virus.
Human fæces kan indeholde mere end 1x106 infektiøse virus per gram. I spildevand er der målt viruskoncentrationer på op til 1x105 pr. l. Da viruspartikler kan bevare infektiøsiteten flere måneder i vand, anses spildevand for at være den vigtigste kilde til human patogen virusforurening af de toskallede bløddyrs miljø (25).
Der er til dato ikke rapporteret om virusinfektioner efter indtagelse af ikke-toskallede bløddyr, såsom hummer og reje, og det antages, at disse bløddyr ikke udgør nogen risiko for transmission af virus.
5.1.2Hvilke toskallede bløddyr
Man har fundet human virustransmission i forbindelse med indtagelse af mange arter af toskallede bløddyr. Dette gælder asiatisk østers (Crassostrea virginica), europæisk østers (Ostrea edulis), Sydney Rock østers (Crassostrea commercialis), Pacific østers (Crassostrea gigas) hårdskals musling (Mercenaria Mercenaria) blødskals musling (Mya arenaria), blåmusling (Mytilis edulis), hjertemusling (cardium edul) og forskellige italienske og kinesiske muslinger (26).
5.1.3Hvilke virus opkoncentreres i toskallede bløddyr
Norwalk virus - Hepatitis A virus - Enstrenget RNA genom
De humane virus, der kan overleve i miljøet, er primært enteriske virus, som er meget resistente overfor ydre påvirkning. Dette gælder Adenoviridae, Caliciviridae, Astroviridae og Picornaviridae, og det er hovedsageligt gruppen af Norwalk virus (tilhørende genus Calicivirus inden for familien Caliciviridae) og hepatitis A virus (tilhørende genus Hepatovirus inden for familien Picornaviridae), der har været årsag til epidemier i forbindelse med indtagelse af toskallede bløddyr. Både Norwalk virus og hepatitis A virus har et enkeltstrenget RNA genom med positiv sense, og begge virus er stabile og relativt resistente mod klorin (30).
Norwalk virus - Symptomer
Norwalk virus kan forårsage akut gastroenteritis, inkubationstiden er kort (1-2 døgn), og den akutte kliniske fase varer typisk 1-2 døgn. Symptomerne er utilpashed, mavesmerter, feber, diarré og/eller opkastning (27).
Hepatitis A virus - Symptomer
Hepatitis A virus kan forårsage sygdom i form af akut hepatitis. Symptomerne er feber, kvalme og hovedpine, der efterfølges af opkast, diarré, artritis og eventuelt gulsot. Infektionen er selvbegrænsende og sjælden fatal. Inkubationstid for infektion er 2-6 uger med en gennemsnitstid på 28 dage (55).
Virusepidemi
Der har været flere udbrud med hepatitis A virus forårsaget af indtagelse af toskallede bløddyr. Det største udbrud indenfor de seneste år opstod i Shanghai i 1988, hvor der blev rapporteret over 300.000 tilfælde af hepatitis A virusinfektioner (28, 29). Det var primært unge mennesker, som havde indtaget rå muslinger fra forurenet vand, der blev angrebet. Senere opstod sekundær smitte ved person til person transmission.
5.1.4Virusepidemier i Danmark som følge af indtagelse af toskallede bløddyr
Norwalk virus - Epidemi 1995/1996
Omkring årsskiftet 1995/1996 registreredes der i Danmark sygdom hos mindst 224 personer efter indtagelse af østers. Symptomerne var opkast, diarré og kraftige mavesmerter, som optrådte 1-2 døgn efter indtagelse og varede 1-2 døgn. De østers, der menes at have relation til sygdomsudbruddet, stammede fra 3 partier á 25000 stykker fra England. Østers fra de tre partier blev sendt til undersøgelse på Fish Disease Laboratory i Weymouth, England. Der blev påvist Norwalk virus ved polymerase chain reaction (PCR)(31).
Symptomer - Ny epidemi nytår
Omkring nytår, det efterfølgende år, optrådte et nyt sygdomsudbrud, hvor mere end 350 personer blev syge efter indtagelse af europæiske østers. De registrerede symptomer var opkast, diarré, feber og hovedpine med efterfølgende synsforstyrrelser, svimmelhed, følelsesløshed af hud, ansigt, hænder og ben. De neurale symptomer opstod hos 50% af personerne og varede op til 3-4 uger.
Small Round Structured Virus
I 13 ud af 25 fæcesprøver blev der påvist Small Round Structured Virus (SRSV) ved elektronmikroskopi, udført af Virologisk afdeling, Statens Serum Institut, København. Østersprøver blev fundet positive for Norwalk virus og enterovirus ved PCR udført af Fish Disease Laboratory i Weymouth (32).
5.1.5Indikator
Indikator
I Fiskeriministeriets bekendtgørelse fremgår grænseværdier på 300 fækale coliforme bakterier eller mindre end 230 E.coli pr. 100 g væv og væske for, at de levende toskallede bløddyr må anvendes direkte til konsum (54). Flere studier har dog vist, at enteriske virus kan være til stede i toskallede bløddyr og give anledning til toskallede bløddyrsbåret sygdom, også når antallet af indikatorbakterier har været indenfor det acceptable niveau (26).
Bakteriofager
Male-specifikke (F+) bakteriofager har været foreslået som indikator for viral forurening af havmiljø, og disse (F+) bakteriofager har også været benyttet i rensningsstudier af toskallede bløddyr (33).
5.1.6Viruselimination fra toskallede bløddyr ved rensning og genudlægning
Rensning og genudlægning er metoder, der er baseret på, at toskallede bløddyr er i stand til via deres filterernærende mekanisme, fordøjelse og ekskretion at eliminere kontaminerende mikroorganismer fra fordøjelseskanalen.
Rensning - Genudlægning
Rensning af toskallede bløddyr kan foregå i tanke eller bassiner med vand behandlet med ultraviolet lys eller ozon (34). For at opnå optimal rensning er det vigtigt, at de øvrige miljømæssige betingelser er bevaret. Rensning kan også ske ved genudlægning, der indebærer, at de toskallede bløddyr flyttes til et område i de naturlige omgivelser, der ikke er forurenet.
Uoverensstemmelse
Den konventionelle rensningstid er 48 timer, og der er observeret overensstemmelse mellem eliminationsraten for bakterielle patogener og fækale indikatorbakterier. Derimod er der forskel i eliminationsraten for indikatorbakterier og virus. Endvidere er der undersøgelser, der peger på at hepatitis A virus ikke elimineres med samme hastighed som enterovirus. Dette kan forklare, hvorfor der har været hepatitis A udbrud i forbindelse med indtagelse af såkaldt "rensede" østers. I et andet studie (34), hvor en gruppe frivillige personer indtog toskallede bløddyr, der var renset i 48 timer og indeholdt et acceptabelt niveau af fækale indikatorbakterier, blev 37 % af gruppen syge som følge af infektion med Norwalk virus.
Elimineringsrater
Elimineringsraterne af forskellige indikatormikroorganismer i muslinger og østers er undersøgt. Bakteriofager blev elimineret væsentligt langsommere end tilfældet var for fækale coliforme, E. coli, enterococci og en sporedannende anærob bakterie (Clostridium perfringens). Uanset om rensningssystemet bestod af ozonbehandlet vand eller vand behandlet med ultraviolet lys, var der stadig bakteriofager i de rensede toskallede bløddyr efter 2 uger (57).
Ovenstående peger på, at fækale coliforme, heller ikke i denne sammenhæng, er en tilstrækkelig indikator for viruskontaminering.
5.2Generelt om metoder til påvisning af virus i toskallede bløddyr
Flere oversigtsartikler over virus af human oprindelse i toskallede bløddyr er inkluderet i nærværende litteraturliste (24, 26, 34, 35, 36, 37). De fleste publikationer på området omhandler studier af eksperimentelt virussåede toskallede bløddyr, hvor virusoptagelse, spredning og elimination i de toskallede bløddyr er undersøgt.
Opkoncentrering
Virus findes generelt i så lave koncentrationer i toskallede bløddyr, at de som regel ikke kan detekteres ved isolation i cellekulturer uden en forudgående opkoncentrering og elimination af cytotoxiske forbindelser. Der findes forskellige metoder til dette formål, hovedparten af metoderne indebærer homogenisering af toskallede bløddyrkødet med eller uden diluent, efterfulgt af centrifugering med henblik på at fjerne fast materiale, jf. bilag 8.
Cellekultur - Fordel - Ulemper
Før molekylærbiologiske metoder, som PCR og hybridisering, blev udviklet, var cellekultur assay den primære teknik til at detektere virus i toskallede bløddyr. En fordel ved disse metoder er, at det er infektiøse virus, der detekteres. Til gengæld er metoderne behæftet med væsentlige ulemper, idet metoderne er tids- og arbejdskrævende og varierer i sensitivitet afhængig af virustype, celletype og inokulationsmaterialet. Inokulationsmaterialet fra toskallede bløddyr kan i høj grad have en cytotoksisk effekt i cellekulturen, og en anden væsentlig ulempe er, at visse virus enten slet ikke eller kun vanskeligt kan isoleres i cellekulturer. Dette gælder eksempelvis hepatitis A virus, der gror meget dårligt og langsomt i cellekulturer, og Norwalk virus, der ikke har vist sig at være dyrkbare in vitro. Ligeledes har enterovirus vist sig at være vanskelige at isolere i cellekulturer fra toskallede bløddyrsmateriale (27). Cellekultur assays er således ikke egnede metoder til påvisning af hepatitis A og Norwalk virus i toskallede bløddyr.
Immunologiske assay - Lav sensitivitet
Immunologiske assay system, som EIA (enzyme immunosorbent assay) og RIA (radio immuno assay) har også været benyttet til at påvise virusantigen i materiale fra toskallede bløddyr. Disse metoder har dog ikke vist sig at have en tilstrækkelig høj følsomhed (35). Således blev den nedre detektionsgrænse bestemt til 104-105 partikler/g for RIA (30).
Elektronmikroskopi
Elektronmikroskopi giver mulighed for visuelt indtryk af viruspartikler i prøvematerialet, men ulempen ved at benytte elektronmikroskopi er, at detektionsgrænsen kan være helt op til 106 viruspartikler/g/ml. For små virus, som picornavirus, kan detektionsgrænsen være endnu højere (56).
Denne høje detektionsgrænse gør, at metoden ikke er velegnet til direkte detektion af virus i toskallede bløddyr.
5.3 Molekylærbiologiske metoder
Molekylærbiologiske metoder - PCR
Den seneste udvikling inden for det molekylærbiologiske felt har ført til udvikling af hurtige, sensitive og specifikke metoder til påvisning af virus i toskallede bløddyr (38 - 47). Den højeste sensitivitet i forbindelse med viruspåvisning i toskallede bløddyr er således opnået med metoder, der gør brug af amplifikation af virus-nukleinsyre i prøvematerialet polymerase chain reaction (PCR). PCR-teknikker er beskrevet nærmere i bilag 9.
For enterovirus vedkommende er der fundet primere, der detekterer en bred række af stammer inden for genus (38).
Kloning af genomer af hepatitis A virus og Norwalk virus, som er de primære humane virale patogener, der kan overføres via toskallede bløddyr, har muliggjort udviklingen af genteknologiske metoder til påvisning af også disse virus (35).
For Norwalk virus er der endnu ikke udviklet et enkelt sæt primere, der kan amplificere alle kendte genotyper.
Fordele
Fordele ved PCR er følgende:
• øget sensitivitet.
• resultat opnås generelt hurtigere end ved andre virusdetektionsmetoder
• en bred vifte af virus kan påvises
Ulemper
Ulemper ved PCR er følgende:
• i forbindelse med prøver fra toskallede bløddyr kan der opstå problemer som følge af kemiske inhibitorer, der hæmmer en eller begge enzymer (revers transkriptase og Taq-polymerase) i processen. Der er forsket i at udvikle ekstraheringsprocedurer, der eliminerer disse kemiske inhibitorer (39, 40, 41, 42) .
• i forbindelse med påvisning af virus i toskallede bløddyr har man fundet, at bløddyrenes polysakkarider hæmmer reaktionerne. Ved anvendelse af en kationisk detergent som cetyltrimethylammonium bromid (CTAB) til prøvematerialet efter fenol-kloroform ekstrahering eliminineres disse polysakkarider (42).
5.4 PCR anvendt til påvisning af virus i toskallede bløddyr
Anvendelse af PCR er beskrevet for hepatitis A virus, for rotavirus, for Norwalk virus og for enterovirus (39 - 47, 51). En del af disse studier omhandler udvikling af metoder til at isolere virale nukleinsyrer fra toskallede bløddyr, der i forvejen eksperimentelt er tilsat virus.
RT-PCR til detektion af Norwalk virus
Nogle af de seneste velunderbyggede studier over detektion af virus i toskallede bløddyr er gennemgået i bilag 10 - 12. Teknikkerne er følgende: RT-PCR til detektion af Norwalk virus i toskallede bløddyrsvæv (49, bilag 10), detektion af hepatitis A virus i miljøprøver herunder toskallede bløddyr ved antigen-capture RT-PCR (51, bilag 11) og detektion af hepatitis A virus, rotavirus og enterovirus i toskallede bløddyr ved seminested RT-PCR (38, bilag 12).
Evaluering af RT-PCR
Evaluering af RT-PCR til detektion af Norwalk virus i toskallede bløddyr (49) viste, at teknikken kunne detektere 4200 kopier af Norwalk virus RNA genom i 1,5 g væv fra toskallede bløddyr. Resultaterne viste endvidere, at hybridiseringsassay øgede sensitiviteten og specificiteten. I nogle tilfælde optrådte falske negative prøver, hvilket skyldtes tilstedeværelsen af PCR-inhibitorer i prøvematerialet.
Påvisning af Hepatitis A virus
Til påvisning af hepatitis A virus i miljøprøver, herunder toskallede bløddyr er en antigen capture teknik beskrevet (51, bilag 11). En fordel ved antigen capture RT-PCR er, at hele viruspartikler fanges af antistof, inden RT-PCR foretages. Dermed kombineres specificiteten af antigen capture af virus med sensitiviteten ved PCR. Metoden involverer ikke tidskrævende RNA ekstraherings- og præpareringstrin, i modsætning til konventionel RT-PCR-teknik (bilag 10). Endvidere forekommer antigen-capture proceduren at være effektiv til at eliminere RT-PCR inhibitorer i prøvematerialet.
Seminested RT-PCR
Sensitiviteten af antigen capture RT-PCR er af samme størrelsesorden som konventionel RT-PCR, men en egentlig detektionsgrænse er ikke beskrevet i nærværende litteraturgennemgang.
Semi-nested RT-PCR er anvendt til detektion af hepatitis A-, entero- og rotavirus i toskallede bløddyr fra naturen (38, bilag 12). Princippet i semi-nested RT-PCR er, at man udfører en ekstra PCR på sit første PCR produkt. Ved anden PCR amplificering anvendes den ene af primerne fra den første PCR, medens den anden primer svarer til et område længere inde på det først amplificerede produkt (teknikken er beskrevet i bilag 12).
I det beskrevne arbejde (38) konkluderedes det, at semi-nested PCR var mere sensitiv, altså havde lavere detektionsgrænser, end konventionel PCR. Efterfølgende hybridisering af PCR-produkter til probe øgede yderligere sensitiviteten, hvilket er i overensstemmelse med tidligere fund (49). Det skal understreges, at der ikke fandtes nogen korrelation mellem påvisning af viral og bakteriel forurening i prøverne fra de toskallede bløddyr, hvilket bekræfter, at bakterielle indikatorer er utilstrækkelige som mål for, at toskallede bløddyr er fri for infektiøse humane patogene virus.
Detektionsgrænser
Der er i følge nærværende litteraturstudie rapporteret følgende detektionsgrænser for virus i toskallede bløddyr ved PCR-metoder: 1200 hepatitis A virus-partikler/g væv, 2000 enterovirus-partikler/g væv og 5000 rotavirus partikler/g væv (38). For Norwalk virus er fundet en detektionsgrænse på 4200 viruspartikler/1,5 g væv (49).
Laveste infektiøse enhed
Det skal i den forbindelse nævnes, at den laveste infektiøse enhed, eksempelvis for Norwalk virus i den menneskelige organisme, sandsynligvis ligger under de hidtil undersøgte molekylærbiologiske teknikkers detektionsgrænser.
Oversigt over fordele og ulemper
En oversigt over fordele og ulemper, samt detektionsgrænser ved de forskellige metoder til detektion af virus i toskallede bløddyr findes i bilag 13.
5.5Opsummering og diskussion.
Vurdering af PCR-metoden
Efter en gennemgang af aktuelle videnskabelige artikler vedrørende metoder til virusdetektion i toskallede bløddyr, kan der konkluderes at RT-PCR og efterfølgende hybridisering er en anvendelig og lovende metode. En teoretisk indsigelse mod PCR-teknikken generelt er, at der "kun" detekteres nukleinsyre, hvilket ikke er ensbetydende med tilstedeværelsen af infektiøse virus. Imidlertid stammer nukleinsyre, der er isoleret fra enteriske virus, i stort omfang fra intakte virioner.
Enteriske virus er typisk effektive til at lave fuldlængde kopier af deres genom, så en positiv reaktion med PCR er en god indikation for, at det originale materiale indeholder infektiøs virus (38, 52). Forsøg har vist, at der ikke kan amplificeres viral RNA i miljøprøver (havvand), når proteinase K digestion, der nedbryder viruskapsidet, er udeladt (38). Dette peger på, at det hovedsageligt er indkapslet viralt RNA, der amplificeres ved PCR.
Kombination af PCR og cellekultur
Hvis infektiøsitet ønskes bekræftet, ville det være relevant at kombinere PCR og cellekultur assay i de tilfælde, hvor virus kan vokse i kulturer. Imidlertid har enterovirus fra toskallede bløddyr og hepatitis A virus vist sig vanskelige at isolere i cellekulturer, og Norwalk virus er som tidligere nævnt ikke dyrkbare in vitro. En undersøgelse fra 1995 (53) belyser det generelle forhold, at det er uhyre vanskeligt, at finde en realistisk korrelation mellem RT-PCR detekterede virusnukleinsyre og infektiøse virus.
Anvendeligheden af PCR og cellekultur
Crance et al. (53) undersøgte således korrelationen mellem infektiøse hepatitis A virus (cellekultur) og hepatitis A virus RNA fundet ved nested-RT-PCR i blåmuslinger og hjertemuslinger fra toskallede bløddyrsbede. Disse havde kort forinden været årsag til toskallede bløddyrsbåret hepatitis A virus udbrud. Viralt RNA blev detekteret i 16 prøver ved semi-nested RT-PCR, mens replikation i cellekultur kun blev observeret i 4 af de PCR positive prøver.
Konklusion
Som konklusion på nærværende litteratursøgning forekommer antigen capture RT-PCR med efterfølgende hybridiseringer på væv fra toskallede bløddyr at være en god strategi. Resultater har vist, at det er vigtigt at isolere mave og digestive divertikler, hvori virus befinder sig, fremfor at udføre PCR på toskallede bløddyrsvævet i sin helhed (50). Ved denne reduktion af prøvematerialet reduceres også mængden af PCR-inhibitorer.
Fordel ved RT-PCR
Antigen capture RT-PCR har, som tidligere nævnt, den fordel at hele viruspartikler fanges af antistof. Problemet er imidlertid, at der ikke er beskrevet et antistof rettet mod en bred række af Norwalk virus i denne litteratursøgning og gennemgang.
Enterovirus som indikator
Enterovirus er en mulig kandidat som indikator for tilstedeværelse af human enteriske virus i toskallede bløddyr, idet der er fundet primere, som kan detekterer en bred række af virus inden for genus (38).
Andre alternativer
Adenovirus, bakteriofager, og andre virus kan være mulige alternativer. Fremtidig forskning på området bør fokusere nærmere på muligheden for anvendelse af indikatorvirus til evaluering af humane enteriske virus forekomst i toskallede bløddyr, vand og relaterede miljøprøver.
6. Referencer
- Rådets Direktiv af 15. juli 1980 om kvaliteten af drikkevand (80/778/EØF).
- Rådets Direktiv af 30. oktober 1979 om kvalitetskrav til skaldyrvande(79/923/EØF).
- Rådets Direktiv af 8. december 1975 om kvaliteten af badevand (76/160/ EØF).
- Sellwood, J. og Wyn-Jones, P. (1996): Viruses in Water: Present Knowledge and Future Opportunities. Microbiology Europe Vol. 4 No. 6, pp 11-16.
- Nickelsen, C. og Krongaard Kristensen, K. (1991): Hygiejnisk kvalitet af spildevand fra renseanlæg. Spildevandsforskning fra Miljøstyrelsen. Nr.21.
- Alexander, L.M.; Heaven, A.; Tennant, A and Morris, R. (1992): Symptomatology of Children in Contact with Sea Water Contaminated with Sewage. Journal of Epidemiology and Community Health; 46: 340-344.
- Grohmann, G. (1996): Detection Methods for Enteric Viruses. Water Microbiology for the 21st Century. 8th - 10th August, 1996. Stockholm. Swedish Institute for Infectious Disease Control. Edited by N.J.Ashbolt. Papers for day 1, pp. 7.1-7.7 and Laboratory Manual, C2.
- Abbaszadegan, M.; Huber, M.S.; Gerba, C.P. og Pepper, I.L. (1993): Detection of Enteroviruses in Groundwater with the Polymerase Chain Reaction. Applied and Environmental Microbiology, Vol. 59, No. 5, pp. 1318-1324.
- Puig, M.; Jofre, J.; Lucena, F.; Allard, A.; Wadell, G. and Girones, R. (1994): Detection of Adenoviruses and Enteroviruses in Polluted Waters by Nested PCR Amplification. Applied and Environmental Microbiology. Vol. 60, No. 8, pp. 2963-2970.
- Metcalf, T.G.; Melnick, J.L. and Estes, M.K. (1995): Environmental Virology: From Detection of Viruses in Sewage and Waters by Isolation to Identification by Molecular Biology - A Trip of Over 50 Years. Annu. Rev. Microbiol. 49: 461-487.
- American Public Health Association (1995): Standard Methods for the Examination of Water and Wastewater. 19th Edition. Managing Editor: Franson, M.A.H.; APHA Washington DC.
- Gerba, C. (1996): Detection of Enteric Viruses in Water. Water Microbiology for the 21st Century. 8th - 10th August, 1996. Stockholm. Swedish Institute for Infectious Disease Control. Edited by N.J.Ashbolt. Laboratory Manual C1.
- Jothikumar, N.; Khanna, P.; Paulmurugan, R.; Kamatchiammal, S. and Padmanabhan, P. (1995: A Simple Device for the Concentration and Detection of Enterovirus, Hepatitis E Virus and Rotavirus from Water Samples by Reverse Transcription-polymerase Chain Reaction. Journal of Virological Methods, 55, pp. 401-415.
- Ju-Fang, M.; Gerba, C.P. og Pepper I.L. (1995): Increased Sensitivity of Poliovirus Detection in Tap Water Cencentrates by Reverse Transcriptase-Polymerase Chain Reaction. Journal of Virological Methods 55, pp. 295-302.
- Murphy, A.M.; Grohmann, G.S. and Sexton, M.F.H. (1983): Infectious Gastroenteritis in Norfolk Island and Recovery of Viruses from Drinking Water. J. Hyg. Camb., 91, 139-146.
- Shieh, Y.S.C.; Wait, D and Sobsey, M.D. (1995): Methods to Remove Inhibitors in Sewage and other Fecal Wastes for Enterovirus Detection by Polymerase Chain Reaction. Journal of Virological Methods, 54, pp. 51-66.
- Schwab, K.J., De Leon, R. and Sobsey, M.D. (1993): Development of PCR Methods for Enteric Virus Detection in Water. Wat. Sci. Tech. Vol. 27, No. 3-4, pp. 211-218.
- Dahling, D.R.; Wright, B.A. and Williams, F.P. (1993): Detection of Viruses in Environmental Samples: Suitability of Commercial Rotavirus and Adenovirus Tests Kits. Journal of Virological Methods. 45, pp. 137-147.
- Wyn-Jones, A.P.; Pallin, R.; Sellwood, J. og Tougianidou, D. (1995): Use of the Polymerase Chain Reaction of Enteroviruses in River and Marine Recreational Waters. Wat.Sci.Tech. Vol. 31, No. 5-6, pp. 337-334.
- Woolfaardt, M.; Moe, C.L. and Grabow, W.O.K. (1995): Detection of Small Round Structured Viruses in Clinical and Environmental Samples by Polymerase Chain Reaction. Wat. Sci. Tech. Vol. 31, No. 5-6, pp. 375-382.
- Kopecka, H.; Dubrou, S.; Prevot, J.; Marechal, j. and López-Pila, M. (1993): Detection of Naturally Occurring Enteroviruses in Waters by Reverse Transcription, Polymerase Chain Reaction, and Hybridization. Applied and Environmental Microbiology. Vol. 59, No. 4, pp. 1213-1219.
- Le Guyader, F.; Menard, D.; Pommepuy, M. og Kopecka; H. (1995): Use of RT Seminested PCR to Assess Viral Contamination in Caribbean Rivers (Martinique). Wat. Sci. Tech. Vol. 31, No. 5-6, pp. 391-394.
- Girones, R.; Puig, M.; Allard, A. Lucena, F. Wadell, G. and Jofre, J.1995): Detection of Adenovirus and Enteroviruse by PCR Amplification in Polluted Waters. Wat. Sci. Tech. Vol. 31, No. 5-6, pp. 351-357.
- Bouchriti N; Goyal SM
Evaluation of three methods for the concentration of poliovirus from oysters
Microbiologica. 1992 Oct; 15(4): 403-8 - Thomsen B.
Zoologi II
Nordisk forlag 1974, 7. udg. 6 oplag - Jaykus LA; Hemard MT; Sobsey MD
Environmental Indicators and Shellfisk Safety: Human Enteric Pathogenic Viruses
Chapman & Hall, New York , London 1994. - Kapikian AZ, Estes MK, Chanonk RM
Norwalk Group of Viruses in Fields Virology
Third Edition vol.1 Lippincott-Raven
Publishers, Philadelphia-New York, 1996. - Halliday ML; Kang LY; Zhou TK; Hu MD; Pan QC; Fu TY; Huang YS; Hu SL
An epidemic of hepatitis A attributable to the ingestion of raw clams in Shanghai, China.
Infect. Dis. 1991 Nov; 164(5): 852-9 - Wang JY; Hu SL; Liu HY; Hong YL; Cao SZ; Wu LF
Risk factor analysis of an epidemic of hepatitis A in a factory in Shanghai.
Int. J. Epidemiol. 1990 Jun; 19(2): 435-8 - Nørrung B, Jacobsen BL
Levnedsmiddelbårne virusinfektioner
Alimenta 1996 19/2 - Christensen BF, Bjergskov T
Levnedsmiddelforgiftning forårsaget af østers.
Dansk Veterinærtidsskrift 1996, 79, 11, 1/6. - Outbreak of human foodborne infection caused by oysters packed in Holland.
Rapport fra Veterinærdirektoratet, Landbrugs- og fiskeriministeriet januar 1997 (file nr.4949-15-0/96) - Dore WJ; Lees DN
Behavior of Escherichia coli and male-specific bacteriophage in environmentally contaminated bivalve molluscs before and after depuration.
Appl. Environ. Microbiol. 1995 Aug; 61(8): 2830-4 - Viral Disease transmission by seafood
De Leon R; Gerba CP, De Leon R; Jo Nriagu (ed.);MS Simons
Advances in Environmental Science and Technology 1990, 639-62;
New York: John Wiley & Sons, Inc.; USA. - Williams JR; Shay Fout G
Contamination of shellfish by stool-shed viruses: Methods of detection.
Environ. Sci. Technol. 1992, 26, 689-96. - Idema GK; Bateman BW, Kfir R; Grabow WOK
A comparison of methods for isolation of a wide range of viruses from shellfish Wat. Sci. Tech. 1991, vol.24, no.2 pp 427-30. - Bouchriti N; Goyal SM
Methods for the concentration and detection of human enteric viruses in shellfish: a review.
Microbiologica. 1993 Jan; 16(1): 105-3 - Le Guyader F; Dubois E; Menard D; Pommepuy M
Detection of hepatitis A virus, rotavirus, and enterovirus in naturally contaminated shellfish and sediment by reverse transcription-seminested PCR.
Appl. Environ. Microbiol. 1994 Oct; 60(10): 3665-71 - Lees DN; Henshilwood K; Dore WJ
Development of a method for detection of enteroviruses in shellfish by PCR with poliovirus as a model.
Appl. Environ. Microbiol. 1994 Aug; 60(8): 2999-3005 - Apaire Marchais V; Ferre Aubineau V; Colonna F; Dubois F; Ponge A; Billaudel S
Development of RT-semi-nested PCR for detection of hepatitis A virus in stool in epidemic conditions.
Mol. Cell. Probes. 1994 Apr; 8(2): 117-24 - Jaykus L.A, De Leon R., Sobsey M.D
Application of RT-PCR for the detection of enteric viruses in oysters.
Wat. Sci. Tech. 1993, vol. 27, no 3-4, 49-53 - Atmar RL; Metcalf TG; Neill FH; Estes MK
Detection of enteric viruses in oysters by using the polymerase chain reaction.
Appl. Environ. Microbiol. 1993 Feb; 59(2): 631-5 - Lees DN; Henshilwood K; Green J; Gallimore CI; Brown DW
Detection of small round structured viruses in shellfish by reverse transcription-PCR.
Appl. Environ. Microbiol. 1995 Dec; 61(12): 4418-24 - Le Guyader F; Apaire Marchais V; Brillet J; Billaudel S
Use of genomic probes to detect hepatitis A virus and enterovirus RNAs in wild shellfish and relationship of viral contamination to bacterial contamination.
Appl. Environ. Microbiol. 1993 Nov; 59(11): 3963-8 - Goswami BB; Koch WH; Cebula TA
Detection of hepatitis A virus in Mercenaria mercenaria by coupled reverse transcription and polymerase chain reaction.
Appl. Environ. Microbiol. 1993 Sep; 59(9): 2765-70 - Jaykus L.A; DeLeon R.; Sobsey M.D.
Development of Molecular Method for the Detection of Enteric Viruses in Oysters.
Food Protect.1995, vol.58, no.12, 1357-62 - Sugieda M.; Nakajima K; Nakajima S.
Outbreaks of Norwalk-like virus-associated gastroenteritis traced to shellfish: coexistence of two genotypes in one specimen
Epidemiol. Infect. 1996, vol. 116, 339-46. - Atmar RL; Neill FH; Romalde JL; Le Guyader F; Woodley CM; Metcalf TG; Estes MK
Detection of Norwalk virus and hepatitis A virus in shellfish tissues with the PCR.
Appl. Environ. Microbiol. 1995 Aug; 61(8): 3014-8 - Atmar RL; Neill FH; Woodley CM; Manger R; Fout GS; Burkhardt W; Leja L; McGovern ER; Le
Guyader F; Metcalf TG; Estes MK.
Collaborative evaluation of a method for the detection of Norwalk virus in shellfish tissues by PCR.
Appl. Environ. Microbiol. 1996 Jan; 62(1): 254-8 - Romalde JL; Estes MK; Szucs G; Atmar RL; Woodley CM; Metcalf TG
In situ detection of hepatitis A virus in cell cultures and shellfish
tissues.
Appl. Environ. Microbiol. 1994 Jun; 60(6): 1921-6 - Deng MY; Day SP; Cliver DO
Detection of hepatitis A virus in environmental samples by antigen-capture PCR.
Appl. Environ. Microbiol. 1994 Jun; 60(6): 1927-33 - Sellwood J, Wyn Jones P
Viruses in water: Present knowledge and future opportunities
Microbiol. Eur. 1996, vol.4 , no.6 - Crance JM; Apaire Marchais V; Leveque F; Beril C; Le Guyader F; Jouan A; Schwartzbrod L;
Billaudel S.
Detection of hepatitis A virus in wild shellfish
Marine Pollution Bulletin 1995, vol.30, no.6, pp 372-5 - Fiskeriministeriets bekendtgørelse nr.202 af 15. april 1993
- Hollinger B F; Ticehurst JR
Hepatitis A Virus in Fields Virology
Third Edition vol.1 Lippincott-Raven
Publishers, Philadelphia-New York, 1996. - McIntosh-K
Diagnostic Virology in Fields Virology
Third Edition vol.1 Lippincott-Raven
Publishers Philadelphia-New York, 1996. - Burkhardt III W, Rippey S-R, and Watkins W-D.
Depuration rates of Northern Quahogs, Mercenaria mercenaria (Linneaeus,1758) and Eastern Oysters Crassostrea Virginica (Gmelin,1791) in ozone-, and ultraviolet light-disinfected seawater systems.
J. of Shellfish Res., vol.11, No.1, 105-109, 1992.
BILAG 1
Fortegnelse over databaser for litteratursøgning
(1993-1997)
AGRICOLA
AGRIS
AQUATIC SCIENCE ABSTRACTS
ARTIKELBASEN
BIOLOGICAL ABSTRACTS (BIOSIS)
CA SEARCH
CAB ABSTRACTS
CURRENT CONTENTS SEARCH
DANDOK
EMBASE
EI COMPENDEX
FOODLINE
FOOD SCIENCE AND TECHNOLOGY ABSTRACTS
MEDLINE
NTIS
POLLUTION ABSTRACTS
SCIENCE CITATION INDEX
WATER RESOUR.ABSTRACTS
WATERNET (TM)
BILAG 2
Metoder til opkoncentrering af virus fra vand
Tabel: Se her
BILAG 3
Opkoncentreringsmetoders fordele og ulemper
Tabel: Se her
BILAG 4
BILAG 5
Metoder til påvisning af virus i vand, fordele og ulemper.
Tabel: Se her
BILAG 6
BILAG 7
BILAG 8
Eksperimentel virus-kontaminering:
I forbindelse med udvikling af metoder til detektion af virus, kontamineres de toskallede bløddyr kunstigt. Til dette formål findes tre forskellige metoder. Den mest anvendte metode er virus-homogenat-metoden, hvor virus tilsættes til homogeniseret bløddyrskød. Metodens ulempe er, at der er en ringe grad af genfindelse af tilsat virus efter processing og opkoncentrering (se nedenfor).
Den anden metode består i direkte injektion af virus i toskallede bløddyrenes fordøjelseskanal eller hepatopancreas. Denne metode menes at give en bedre genfindelsesprocent end homogenat-metoden.
Den tredje metode består i at lade levende østers akkumulere virus ved at placere dem i tanke eller akvarier med havvand tilsat virus. I nogle tilfælde er der yderligere tilsat stivelsesgranula, som fremmer virusoptagelsen. Metoden efterligner de naturlige betingelser for bioakkumulering og koncentrering af virus i toskallede bløddyr (37).
Metoder til processing og opkoncentrering:
Virus findes generelt i så lave koncentrationer i toskallede bløddyr, at de som regel ikke kan detekteres ved isolation i cellekulturer uden en forudgående opkoncentrering og elimination af cytotoksiske forbindelser.
Der findes forskellige metoder til dette formål, hvoraf hovedparten indebærer homogenisering af bløddyrskødet med eller uden diluent, efterfulgt af centrifugering med henblik på at fjerne fast materiale. Supernatanten kan yderligere behandles med ethylæter eller freon, hvorefter materialet kan testes direkte eller efter et koncentreringstrin.
Koncentreringsmetoder kan klassificeres i 5 kategorier: syre-præcipitation, polyelektrolyt flokkulation, adsorption-elution-ultrafiltration, elution-adsorption-ultrafiltration, og elution-præcipitation (37).
Cellekultur assays, EIA, RIA og elektronmikroskopi er beskrevet i hovedtekst.
BILAG 9
Generel beskrivelse af PCR:
Ved Polymerase Chain Reaction (PCR) syntetiseres der in vitro store mængder af et givent nukleinsyre-segment mellem to oligonukleotid primere. Der kan således dannes store mængder amplificeret nukleinsyre ud fra få kopier af original nukleinsyre ved at gentage en proces bestående af denaturering (dobbeltstrenget DNA separeres til enkeltstrenget) i forbindelse med opvarmning til 950 C og forlængelse af primere med en varmeresistent DNA-polymerase (figur 1). Ved PCR kan man således, på meget kort tid, amplificere et ønsket DNA-segment fra et lille kvantum DNA i et prøvemateriale. Teknikken forudsætter, at de flankerende DNA sekvenser er kendt.
PCR reaktionen har en høj sensitivitet, idet man er i stand til at påvise ned til 10 kopier af en specifik nukleinsyresekvens (fx. virus) i en vævsprøve. Denne detektionsgrænse er dog endnu ikke beskrevet for detektion af virus i toskallede bløddyr.
Fra væv isoleres DNA eller RNA. Proceduren består i, at vævet homogeniseres, cellerne lyseres, proteiner og lipid ekstraheres og endelig udfældes nukleinsyre.
Ved undersøgelse for eksempelvis adenovirus, vil PCR kunne udføres direkte på ekstraheret DNA materiale. For prøver, hvorfra der er ekstraheret RNA, er det dernæst nødvendigt at syntetisere copy DNA (cDNA) ud fra virus RNA sekvenser, inden PCR kan anvendes. Dette gøres ved at inkubere RNA prøven sammen med enzymet revers transkriptase. Når revers transkription foretages før PCR, kaldes metoden RT-PCR. cDNA-prøven blandes derefter med Taq DNA polymerase (varmestabil), dNTP’s og primere i en magnesiumholdig buffer og anbringes til sidst i en thermocykler, der automatisk skifter mellem de tre temperatur (denaturering, primer annealing og primer extension). Som regel lader man reaktionen forløbe over 30-35 cykler.
PCR-produktet kan visualiseres ved agarosegel-elektroforese og ethidiumbromid farvning overfor en kendt DNA markør. Ved denne teknik udnyttes, at DNA er negativt ladet pga. de sure fosfatgrupper. DNA fragmenter bevæges derfor mod den positive pol. Små fragmenter vandrer hurtigere end store. Udfra en kendt DNA-markør på samme gel, kan PCR-produktets størrelse estimeres og sammenholdes med den forventede størrelse af amplikon.
Figur 1 : Se her
PCR er en cyklisk proces, hvor antallet af DNA molekyler fordobles efter hver cyklus. Det dobbelstrengede DNA denatureres ved opvarmning og afkøles derefter, så primeren kan binde til det komplementære område.
Herefter forlænges primeren af DNA polymerasen ved at inkorporere nye komplementære deoxyribonukleotider. Processen kan i princippet gentages i det uendelige. Antallet af kopier er 2n for hvert udgangskopi, hvor n er antallet af cykler. Rutinemæssigt gentages processen ca. 30 gange, dvs. at der dannes 2 30= 1 milliard kopier fra hvert udgangskopi. Da PCR er en meget sensitiv metode, er der risiko for at få PCR reaktionerne kontamineret med falsk positive reaktioner til følge.
Derfor bør man altid have negative kontroller med, benytte pipetter, der kun benyttes til dette formål samt præparere prøver i et rum og blande reaktionsmix og køre reaktionen i et andet rum. Normalt inkluderes også en positiv kontrol.
Nukleinsyre hybridisering:
For at få bekræftet at PCR-produktet er det "rigtige", kan der laves nukleinsyre-hybridisering efterfølgende. Det amplificerede produkt agarosegelelektroforeres, og PCR produktet denatureres og blottes (overføres) over på en nylonmembran.
En nukleinsyre-probe, dvs. en nukleinsyrestreng fremstillet med en basesekvens, der er komplementær til et givent område af det stykke virusnukleinsyre, man ønsker at påvise, anvendes til specifik identificering af PCR-produktet. Proben kan mærkes med radioaktiv 32P.
Nylonmembranen inkuberes med en hybridiseringsvæske indeholdende nukleinsyre-probe. Derefter vaskes membranen og film lægges på. Ved autoradiografi ses, om der er sket en hybridisering (binding af probe) til virusnukleinsyre. Proberne kan også kobles med biotin og digoxigenin, som derefter påvises ved binding til en anden mærket forbindelse.
BILAG 10
Beskrivelse af evalueringsstudie af detektion af virus i toskallede bløddyr ved RT-PCR (49)
I dette studie undersøgte man om 5 uafhængige laboratorier kunne detektere en kendt mængde Norwalk virus i toskallede bløddyr ved RT-PCR.
Forinden udførte alle 5 laboratorier initial tests, hvor de viste, at de ved RT-PCR kunne detektere 42 kopier af Norwalk virus.
Kontrollaboratoriet, der foretog den samlede undersøgelse, præparerede toskallede bløddyr på følgende måde inden udsending til laboratorierne.
Præparation af toskallede bløddyr inden udsending:
Præparation af de toskallede dyr bestod i, at maver og digestive divertikulaer blev udtaget ved dissektion. In situ transkriptionsstudier har tidligere lokaliseret, at hovedparten af Hepatitis A virus bioakkumuleres i mave og digestive divertikler af toskallede bløddyr (50)
For hvert forsøg blev der lavet 3 separate puljer af toskallede bløddyrs maver og digestive divertikulaer. Til disse puljer blev tilsat:
- 100 RT-PCR units af Norwalk virus pr. 1,5 g toskallet bløddyrsvæv til pulje 1
- 1000 RT-PCR units af Norwalk virus pr. 1,5 g toskallet bløddyrsvæv til pulje 2
- negativ kontrol:0 RT-PCR units af Norwalk virus pr. 1,5 g toskallet bløddyrsvæv til pulje 3.
En RT-PCR unit repræsenterede ca. 42 kopier af Norwalk virus-genom (beskrivelse af RT-PCR unit i ref. 48) og blev benyttet, fordi Norwalk virus ikke kan gro i cellekulturer eller kvantificeres ved elektronmikroskopi.
Vævene blev homogeniseret i en opløsning af 7,3 ml PBS og 0,2 ml antifoam per 1,5 g toskallede bløddyr i 4 x 60 sek. intervaller på høj speed med en semi-microcontainer (Eberbach Corp., Ann Arbor, Mich) forbundet til en power unit.
De deltagende laboratorier fulgte følgende protokol:
- lige efter modtagelsen blev 9 ml prøver overført til 50 ml polyallomer rør
- shipping-røret blev skyllet efter med 3 ml PBS, som herefter overførtes til de 9 ml prøve
- 6 ml kloroform:butanol (1:1 vol/vol) blev tilsat hver prøve, der blev blendet på vortex i 2x30 sek. med 15 sek. hvileinterval
- Cat-Floc T (polydimethyl diallyl ammoniumchlorid, en polykationisk elektrolyt, der benyttes ved behandling af spildevand, er succesfuldt blevet benyttet til genfindelse af enterovirus fra østers (24)) blev tilsat til en endelig koncentration på 2,7 procent
- prøverne blev blandet ved vending i 5 min ved stuetemperatur
- centrifugering 13500xg i 15 min ved 40C
- vandig fase blev overført til rent rør indeholdende 6,5 ml af polyethylenglycol PEG 6000 (24%wt/vol) og 1,2 M NaCl
- prøverne inkuberes under svag bevægelse i 1 time ved 40C
- centrifugeredes i 20 min. ved 11000xg ved 40C
- supernatant blev fjernet ved dekantering, og pellet blev opbevaret over nat ved 40C
- dag RNA ekstrahering
- PEG-pellet blev resuspenderet i 3 ml vand
- proteinase K fordøjelse (0,2 mg/ml ved endelig koncentration) i 30 min. ved 560C
- prøverne ekstraheredes 2x med et lige volumen af phenol-chloroform-vand (68:18:14)
- den vandige fase blev præcipiteret i opløsning indeholdende 3 volumner af ethanol og 1/10 volumen af 3 M NaCH3 COO (pH 5,2) i 30 min. med tør-is-ethanol
- centrifugering ved 15000xg i 30 min.
- pellet resuspenderedes i vand
- CTAB (cetyltrimethylammoniumbromid, kationisk detergent, der precipiterer nukleinsyre og nogle proteiner, hvorimod andre proteiner og polysakkarider bliver i opløsningen) og NaCl blev tilsat til endelige koncentrationer på henholdsvis 1,4% og 0,11 M
- prøverne blev inkuberet i 15 min. ved stuetemperatur og centrifugeret 30 min. ved 15000xg ved 250 C
- pellet blev genopløst i 1 M NaCl og præcipiteret i en opløsning indeholdende 3 volumener ethanol og 1/10 volumen 3 M NaCH3COO (pH 5,2)
- det præcipiterede nukleinsyre blev genopløst i 100 m l vand, hvoraf 20 m l blev brugt til RT-PCR.
Revers transkription:
20 m l prøve og en reaktionsblanding på 30 m l bestående af 10mM tris-HCl (pH 8,3), 50 mM KCl, 1,5 mM MgCl2 , 3,3 m M af primer NVp36 (se nedenfor), 667 m M deoxynukleotidtrisphosphat (dNTP),
20U Rnasin og 5 U avian myeloblastosis virus reverse transkriptase blev blandet og inkuberet 1 time ved 430 C
PCR:
Primere: Norwalk virus primerne NVp36 og NVp36 amplificerer polymerase regionen, og området svarer til 470 basepar. Der er sekvensvariabilitet i polymeraseregionen, og der er endnu ikke udviklet et enkelt sæt af primere, der vil kunne amplificere hele Norwalk virus gruppen (27).
- Til reaktionen tilsættes en PCR-blanding på 70 m l bestående af 10 mM tris-HCl (pH 8,3), 50 mM KCl, 1,5 mM MgCl2 , 1 m M af hver primer, 200 m M deoxynukleotidtrisphosphat (dNTP) og 5 U Taq polymerase
- thermocykler var: 940 C i 4 min. (denaturering), 40 cykler af 940 C i 1 min., primer annealing ved 550 C i 1,5 min., primer extension ved 720 C i 1 min., endelig extension ved 720 C i 15 min.
- PCR-prdukt analyseres på agarosegel med DNA-markør, der forventes et DNA-bånd på ca. 470 nukleotider.
Resultater:
Alle resultater, undtagen et (lab.B), havde tolkbare resultater i alle forsøg. Laboratorie B havde negativ svar på de positive kontroller i nogle af forsøgene, også selvom alle reagenser blev udskiftet. Laboratorie D var det eneste, der havde alle resultaterne rigtige.
Der blev fundet en sensitivitet på 81% (antal fundne positive prøver ud af det totale antal prøver med virus) ved detektion af 100 RT-PCR units i 1,5 g toskallede bløddyr mave og digestive divertikula (svarende til 4200 kopier af Norwalk virus RNA genom). Ud af 27 forsøg var der 22 positive reaktioner, hvilket giver en sensitivitet på 81%.
Man fandt 17 positive ud af 19 testprøver, hvor der var tilsat 1000 RT-PCR-units pr. 1,5 g toskallede bløddyr mave og digestive divertikula (svarende til 42000 kopier Norwalk virus RNA genom), resulterende i en sensitivitet på 89%.
Specificiteten, defineret som antal fundne negative prøver (0 virus tilsat) ud af total antal negative prøver, blev bestemt til 91% (21/23, 2 var nemlig falske positive bedømt efter agarose gelelektroforese).
For at analysere resultaterne yderligere udførte kontrollaboratoriet (dvs. det blev udført efter de deltagende laboratorier havde afleveret deres resultater) Southern hybridisering på PCR-produkterne. Herved øgedes sensitiviteten til 85% for 100 RT-PCR units i 1,5 g væv og specificiteten til 100% (ingen af de to tidligere fundne falske positive prøver viste positivt resultat i Southern blot).
Der var kun et laboratorie ud af 5, der fandt positive resultater i alle prøver indeholdende virus. 3 ud af 5 laboratorier havde mindst en "falsk" negativ prøve, hvilket måtte skyldes tilstedeværelse af inhibitorer.
Konklusion:
Teknikken viste, at der kunne detekteres 4200 kopier af Norwalk virus RNA genom i 1,5 g væv fra toskallede bløddyr. Resultaterne viste endvidere, at hybridiseringsassay øgede sensitiviteten og specificiteten. I nogle tilfælde optrådte falske negative prøver, hvilket skyldtes tilstedeværelsen af PCR-inhibitorer i prøvematerialet.
BILAG 11
Detektion af hepatitis A virus i miljøprøver ved antigen capture RT-PCR (46)
I dette studie beskrives en antigen capture RT-PCR metode til detektion af hepatitis A virus i miljøprøver og toskallede bløddyr. Der er her fokuseret på antigen capture RT-PCR på toskallede bløddyr.
Processing:
Østers og muslinger blev tilsat virus, afskallet og hakket. Der blev tilsat kold 0,09 M Glycin i 0,01 NaOH buffer (pH 8,8) og blandet i 1-2 min.. Cat-Floc blev tilsat. Efter blanding inkuberedes i 15 min. ved 40 C. Der blev filtreret gennem Whatmanpapir efterfulgt af filtrering gennem 0,2 µm filter. Filtratet var da klar til analyse ved plaque assay ( infektiøse virus, PFU, i cellekultur) og antigen capture RT-PCR . Ved plaque assay var det nødvendigt at benytte en hurtigt voksende cytolytisk hepatitis A virus variant, da vildtype hepatitis A virus vokser meget langsomt eller slet ikke i cellekulturer.
Antigen-capture:
Sterile 0,5 ml polypropylen mikrocentrifugerør blev coated med anti-hepatitis A virus IgG ved inkubering i 4 timer ved 37 0 C. Ikke-bundet IgG blev fjernet og 1 % bovinserum tilsat. Efter inkubering 1 time ved 37 0 C vaskes 3x med PBS indeholdende Tween. Skaldyrsfiltratet blev tilsat, og der blev inkuberet natten over ved 40 0 C, efterfulgt af vask 6 x i buffer bestående af 20 mM Tris (pH 8,4) + 7,5 mM KCl + 2,5 mM MgCl 2.
Primere:
Der blev benyttet to primere, der flankerer et meget konserveret område kodende for carboxyl- enden af kapsidprotein VP3 og amino-enden af protein VP1.
Reverse transkriptase:
48 µl reaktionsblanding indeholdende PCR-buffer II, 4 mM MgCl 2, deoxyribonukleotider (dNTP) i en koncentration på 0,4 mM og 1,2 µM hepatitis A virus-primer 2. Efter denaturering i 5 min. ved 95 0 C blev der afkølet på is. 1 µl RNase inhibitor (20 U/µl) og 1 µl Moloney murin leukæmivirus revers transkriptase (50 U/µl) blev tilsat. Der blev inkuberet i 30 min. ved 420 C, 5 min. ved 990 C og 5 min. ved 50 C. Produktet er første streng cDNA.
PCR:
Til ovenstående reaktion tilsættes 50 µl af en PCR-blanding bestående af 1x PCR-buffer II, 1,2 µM HAV-primer 1 og 2,5 U Taq DNA-polymerase. Efter opvarmning til 950 C i 2 min. fulgte 35 PCR- cykler af denaturering ved 950 C i 1 min., annealing og extension ved 600 C i 1 min. Afslutningsvis var der 7 min. extension ved 600 C. Dernæst analyseres PCR-produktet (247 basepar) på agarosegel.
Resultater:
Ud fra sensitivitetsstudier på spildevandsprøver fandtes, at antigen capture RT-PCR metodes detektionsgrænse var på 0,053 PFU for en hepatitis A virusstamme (HM175/18f en hurtigt voksende cytolytisk variant), hvorimod detektionsgrænsen ved plaque assay var 1 PFU pr. 0,5 ml podestof (inoculum). Sensitiviteten er altså ca. 20 gange større for antigen capture RT-PCR end for plaque assay. For at estimere hvad en PFU svarede til i viruspartikler, lavede de cDNA-RNA hybridisering og målte optisk densitet (OD). Viruspartikel/PFU ratio fastslås til 79:1. Ud fra dette ræsoneredes, at detektionsgrænsen var på 4 viruspartikler ved antigen capture RT-PCR. Sensitiviteten af antigen capture RT-PCR var af samme størrelsesorden som konventionel RT-PCR.
Forsøg på detektion af virus i toskallede bløddyr ved antigen capture RT-PCR viste sig at være lige så sensitiv som plaque assay forsøg på toskallede bløddyr, når der, vel at mærke, blev anvendt en laboratoriestamme af virus, der gror i cellekultur.
Konklusion:
Sensitiviteten af antigen capture RT-PCR var af samme størrelsesorden som konventionel RT-PCR, men en egentlig detektionsgrænse blev ikke beskrevet i dette studie.
BILAG 12
Beskrivelse af semi-nested RT-PCR på naturligt kontaminerede toskallede bløddyr(38).
Princippet i semi-nested RT-PCR er, at man laver en ekstra PCR på sit første PCR produkt (fig. 2). Hvis der i den første PCR ikke er dannet nok DNA, hvilket kan skyldes, at primere har bundet for svagt, kan man forsøge at amplificere produktet ved at vælge en primer, der binder sig længere inde på det ønskede produkt, medens den anden primer fra 1. PCR anvendes igen. Metoden er mere sensitiv end konventionel PCR.
Første PCR amplifikation med primer 1 og 2
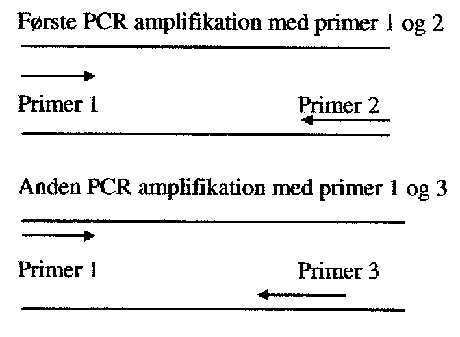
Figur 2. Illustration af semin-nested PCR
I (38) beskrives semi-nested RT-PCR med efterfølgende hybridisering til detektion af hepatitis A virus, rotavirus og enterovirus.
Primere:
Til semi-nested-PCR på enterovirus blev benyttet 3 primere svarende til det meget konserverede 5’ ikke-kodende område i picornavirus (tabel 3). Til detektion af hepatitis A virus ved semi-nested PCR blev benyttet 3 primere, der var relateret til den konserverede sekvens af VP1 kapsidregionen. Til rotavirus-detektion blev benyttet 3 primere svarende til et konserveret område af VP7 genet. Dette område er konserveret inden for gruppe A rotavirus, men meget divergerende blandt forskellige rotavirusgrupper (reviewed af 38).
Tabel 1. Sekvens og lokalisering af oligonukleotider (primere) og prober)
| Virus og oligo- nukleotid |
Sekvens (5’ - 3’) |
Lokali- sering |
Fragment- længde (bp) |
| Hepatitis A virus | |||
| H1 | GGAAATGTCTCAG- GTACTTTCTTTG |
2389- 2413 |
|
| H2 | GTTTTGCTCCTCTTT- ATCATGCTATG |
2167- 2192 |
247 |
| H3 | TCCTCAATTGTTGTGATAGC | 2358- 2377 |
210 |
| Hp | TCAACAACAGTTTCTACAGA | 2233- 2252 |
|
| Enterovirus | |||
| E1 | TCCGGCCCCTGAATGCGG | 446-463 | |
| E2 | CACCGGATGGCCAATCCAAT | 623-642 | 196 |
| E3 | CTCTCAATTGTCACCATAAG | 584-603 | 157 |
| Ep | ACACGGA- CACCCAAAGTAGTCGGTTCC |
533-559 | |
| Rotavirus | |||
| R1 | GGCTTTAAAAGAGAG- AATTTCCGTCTGG |
1-28 | |
| R2 | GATCCTGTTGGCCATCC | 376-392 | 392 |
| R3 | GTATGGTATTGAATATACCAC | 51-71 | 342 |
| Rp | TCCATTGATCCTGTTATTGG | 220-239 |
Revers transkription (RT):
Første streng cDNA blev syntetiseret ved revers transkription med en 10 µl blanding bestående af 2 µl nukleinsyre ekstrakt og 1 µM downstream primer (E1 eller H1). For enterovirus og hepatitis A virus blev RT-blandingen inkuberet i 45 min. ved 370C, opvarmet til 950C i 5 min. og derpå afkølet på is.
Betingelserne for revers transkription af rotavirus var lidt anderledes; 2 µl nukleinsyreekstrakt blev denatureret med 10 µM af downstream primer og 10 mM af methyl mercuric hydroxid i 5 min. ved stuetemperatur, som beskrevet (38).
PCR:
PCR-reaktionsblanding blev udført på følgende måde: 2 µl af RT-blanding (for henholdsvis enterovirus og hepatitis A virus) blev sat til 23 µl af PCR-blanding (med Taq polymerase som angivet af producent Perkin-Elmer Cetus). Rotavirus-amplifikation blev udført på 40 µl af PCR-blandingen tilsat til 10 µl rotavirusblanding som beskrevet ovenfor, dog med ændring i MgCl2 -koncentration.
Amplifikationen var ens for alle tre virus og blev udført på følgende måde:
3 cykler (940C i 30 sek, 500C i 30 sek, 720C i 30 sek), derefter 27 cykler (940C i 15 sek, 500C i 15 sek og 720C i 20 sek), derpå en ekstensionsperiode ved 720C i 2 min. og afslutning med nedkøling til 40C Semi-nested PCR blev udført på følgende måde:
1 µl af første amplifikationsreaktion blev yderligere amplificeret med interne primere (H3, E3 eller R3) og samme upstream primer som ved første PCR. Semi-nested PCR var i øvrigt som ved 1. PCR amplifiaktion som beskrevet ovenfor.
Hybridisering:
PCR produkterne blev analyseret ved agarosegelelektroforese og efterfølgende Southern hybridisering med oligoprobe mærket med digoxigenin-dUTP. For hybridiserings- og vaskebetingelser henvises til artiklen. Hybridisering blev detekteret med anti-digoxigenin antistof konjugeret med alkalisk fosfatase, der defosforylerer chemiluminescent substratet Lumigen PPD. Membraner blev eksponeret med røntgenfilm i 1 time ved 37 0 C inden fremkaldelse.
Sensitivitetsstudier:
Sensitiviteten af metoden blev evalueret ved studier, hvor kendte koncentrationer af virus blev sat til afskallede hjertemuslinger fra et "farming area". Toskallede bløddyrprocessing foregik således:
- 25 g toskallede bløddyr blev afskallet, hvorefter virus blev tilsat
- tilsætning af 100 ml 0,2 M glycin i 0,15 M NaCl (pH 9,5)
- homogenisering i Waring blender i 5 min
- blandingen omrørtes i 15 min. ved stuetemperatur og centrifiguredes i 10 min. ved 10000xg ved 40 C
- vandig fase blev fældet med PEG 6000 i en koncentration på 50% (wt/vol) opløsning i 0,1 M PBS, således at den endelige koncentration var 8%PEG
- pH blev indstillet til 7,0
- blandingen blev omrørt i 2 timer ved 40 C
- centrifugering i 30 min. ved 10000xg og 40 C
- pellet blev suspenderet i 5 ml DEPC vand (diethyl pyrocarbonatbehandlet destilleret vand)
- pH blev justeret til 7,0.
RNA-ekstraktion:
Derpå blev viral RNA ekstraheret fra toskallede bløddyrskoncentraterne på følgende måde:
- 1/10 af ovenstående suspension blev behandlet med en opløsning bestående af 0,1 M Tris-HCl (pH 7), 5 mM EDTA, 1% SDS, proteinase K (200 m g/ml) ved 56 0 C i en time (hermed nedbrydes proteinerne)
- derpå ekstraheredes med phenol:cloroform:isoamyl alkohol (25:24:1) med henblik på at isolere nukleinsyre. Ved ethanolfældning og centrifugering blev RNA opkoncentreret, og pellet opløst i 100 m l DEPC-vand.
Rotavirus nukleinsyre blev oprenset ved adsorption på granular cellulose efter PEG-fældning på følgende måde:
- prøve blev blandet med 2xSTE (vol/vol) (10xSTE i 1M NaCl, 0,01 M EDTA og 0,1 M Tris-HCl (pH 6,8)) indeholdende 66% ethanol (vol/vol) og 10 mg af CC41 cellulose
- blandingen blev omrystet i 45 min. og centrifugeret i 3 min ved 10000xg
- pellet blev vasket 3 gange med 1xSTE-20% ethanolbuffer
- adsorberet RNA blev elueret med 50 m l af DEPC vand i 10 min. ved 550 C efter centrifugering i 3 min. anvendes supernatant til reverse transkription som ovenfor beskrevet.
Resultat efter sensitivitetsstudier:
Ud fra disse sensitivitetsstudier bestemtes, at sensitiviteten for hepatitis A virus var 100 gange større ved semi-nested PCR end ved konventionel PCR. Hybridiseringstrinnet øgede sensitiviteten yderligere en faktor 10. Ved beregninger blev detektionsgrænsen bestemt til 1200 hepatitis A viruspartikler/g toskallet bløddyrvæv ved brug af semi-nested PCR og hybridisering.
For enterovirus fandtes ligeledes, at sensitiviteten er 100 gange større for semi-nested PCR end PCR, men sensitiviteten fandtes ikke yderligere øget ved hybridisering. Efter beregninger var detektionsgrænsen for enterovirus bestemt til 2000 enteroviruspartikler/g toskallet bløddyrvæv ved brug af semi-nested PCR og hybridisering.
For rotavirus blev der kun observeret amplificeret DNA efter oprensning med CC41 cellulose og efter semi-nested PCR. Hybridisering øgede ikke sensitiviteten. Beregninger fastlagde, at detektionsgrænsen for rotavirus var 5000 rotaviruspartikler/g toskallet bløddyrvæv.
Disse sensitiviteter og detektionsgrænser var baseret på den antagelse, at der ikke skete tab af viralt materiale under koncentreringsmetoderne.
Resultat af seminested RT-PCR på naturligt kontaminerede toskallede bløddyr:
Field site 1:
Ud af 20 hjertemuslinger var 3 positive for enterovirus RNA og 1 positiv for hepatitis A virus RNA.
Ud af 10 blåmuslingeprøver var 2 positive for enterovirus RNA, medens ingen prøver fandtes positive for hepatitis A virus RNA.
Bakterielle data indikerede, at næsten alle toskallede bløddyrene var kontamineret over det acceptable niveau, kun 1 prøve var acceptabel bedømt ud fra bakterielle indikatorer.
Field site 2:
Ud af 12 muslingeprøver (clam) var 3 positive for hepatitis A virus RNA, 3 var positive for enterovirus RNA og 2 var positive for rotavirus RNA. Heller ikke her var der korrelation mellem bakteriologiske data og virusfund. Nogle af prøverne var kontamineret med bakterier over det acceptable niveau og andre under.
Hepatitis A virus RNA detektion korrelerede altid med detektion af enterovirus og/eller rotavirus, hvorimod enterovirus RNA alene blev detekteret i flere prøver. De primere, der blev brugt til detektion af enterovirus, detekterer en bred række af typer. Så sandsynligheden for at detektere enterovirus RNA er større end for RNA fra de to andre virus. Undersøgelserne peger på, at enterovirus kan fungere som indikator for mulig tilstedeværelse af andre humane patogene virus.
I samme studie blev forekomst af hepatitis A virus og enterovirus i sedimentprøver (disse behandles direkte med proteinase K og proceduren for toskallede bløddyr følges, efter ethanolfældning laves en oprensning på Sephadex G150 søjle) undersøgt.
Resultaterne viste, at hver gang viralt RNA (entero eller hepatitis A virus) var påvist i sediment, var der også påvist i toskallede bløddyr. Der var næsten dobbelt så meget enterovirus og hepatitis A virus i sediment som i toskallede bløddyr. Det blev konkluderet, at korrelationen mellem viruskontaminering i toskallede bløddyr og sediment yderligere bør undersøges.
Konklusion:
I dette arbejde konkluderedes det, at semi-nested PCR var mere sensitiv, altså havde lavere detektionsgrænser, end konventionel PCR. Efterfølgende hybridisering af PCR-produkter til probe øgede yderligere sensitiviteten, hvilket er i overensstemmelse med tidligere fund (49). Det skal understreges, at der ikke fandtes nogen korrelation mellem påvisning af viral og bakteriel forurening i toskallede bløddyrsprøverne, hvilket bekræfter at bakterielle indikatorer er utilstrækkelige som mål for, at de toskallede bløddyr er fri for viruspatogener.
BILAG 13
Oversigt over forskellige metoder til påvisning af virus i toskallede bløddyr, tabel 2:
| Metode (refe- rencer) |
Fordele | Ulemper | Detektions- grænse |
| RT-PCR (48,49) |
|
|
4200 kopier af RNA- genom/1,5 g væv |
| Antigen capture RT-PCR (51) |
|
|
|
| Semi- nested RT-PCR (38) |
|
|
1200 virus- nukle- insyre/g væv |
| Hybridise- ringsassay |
|
|
|
| Celle- kultur |
|
|
|
| Elektron- mikro- skopi |
|
|
106 viruspar- tikler/g |